题目内容
6.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 使甲基橙变红色的溶液中:K+、Na+、SO42-、CO32- | |
| B. | pH=14的溶液中:K+、Na+、Cl-、AlO2- | |
| C. | 0.1 mol•L-1NH4I溶液中:Na+、Fe3+、Cl-、SO42- | |
| D. | 与铝反应产生大量氢气的溶液中:Na+、NH4+、HCO3-、NO3- |
分析 A.使甲基橙变红色的溶液中存在大量氢离子,碳酸根离子与氢离子反应;
B.pH=14的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.铁离子具有氧化性,能够氧化碘化铵电离出的碘离子;
D.与铝反应产生大量氢气的溶液中存在大量氢离子或氢氧根离子,铵根离子、碳酸根离子与氢氧根离子反应,碳酸氢根离子与氢离子反应,且在酸性条件下硝酸根离子具有强氧化性,与铝反应不会生成氢气.
解答 解:A.使甲基橙变红色的溶液为酸性溶液,溶液中存在大量氢离子,CO32-与氢离子反应,在溶液中不能大量共存,故A错误;
B.pH=14的溶液为碱性溶液,溶液中存在大量氢氧根离子,K+、Na+、Cl-、AlO2-之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.Fe3+、I-之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.与铝反应产生大量氢气的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,NH4+、HCO3-与氢氧根离子反应,HCO3-与氢离子反应,且NO3-在酸性溶液中与铝反应不会生成氢气,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
17.化学与生产生活息息相关.下列说法不正确的是( )
| A. | 乙醇能消毒杀菌 | |
| B. | 锌可用作锌锰干电池的负极材料 | |
| C. | 糖类、油脂、蛋白质均是有机高分子化合物 | |
| D. | 硅可用于制造太阳能光电池 |
14.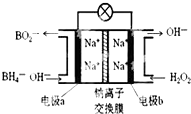 某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
 某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| C. | b极上的电极反应式为:H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mole- |
12.文献报道某课题组利用CO2催化氢化制甲烷的研究过程如图1:
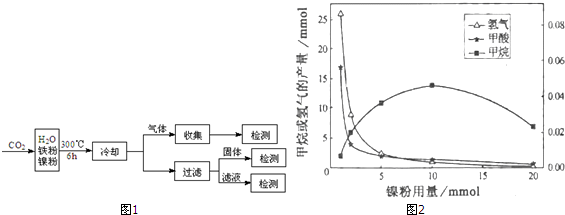
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4.CH4、HCOOH、H2的产量和镍粉用量的关系如图2所示(仅改变镍粉用量,其他条件不变):研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,即:CO2$\stackrel{Ⅰ}{→}$HCOOH$\stackrel{Ⅱ}{→}$CH4.由图可知,镍粉是反应Ⅰ、Ⅱ的催化剂,当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是( )

反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4.CH4、HCOOH、H2的产量和镍粉用量的关系如图2所示(仅改变镍粉用量,其他条件不变):研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,即:CO2$\stackrel{Ⅰ}{→}$HCOOH$\stackrel{Ⅱ}{→}$CH4.由图可知,镍粉是反应Ⅰ、Ⅱ的催化剂,当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是( )
| A. | 反应Ⅰ的速率增加,反应Ⅱ的速率不变 | |
| B. | 反应Ⅰ的速率不变,反应Ⅱ的速率增加 | |
| C. | 反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快 | |
| D. | 反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快 |
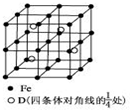 A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有1个电子.
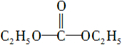 .
.