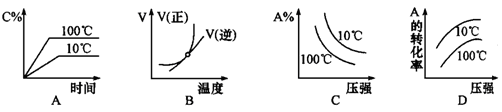
题目内容
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3,的浓度为
| A.0.50mol/L | B.0.60mol/L | C.0.45mol/L | D.0.55mol/L |
B
解析试题分析:根据V=ΔC/Δt可得ΔC(H2)=V·Δt=2s·0.45mol/(L·s)=0.90 mol/L,再由方程式:N2+3H2 2NH3中氢气和氨气的量的关系可知ΔC(NH3)=
2NH3中氢气和氨气的量的关系可知ΔC(NH3)=
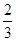 ΔC(H2)=
ΔC(H2)=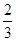 ×0.90 mol/L=0.60 mol/L.正确选项为:D。
×0.90 mol/L=0.60 mol/L.正确选项为:D。
考点:考查化学反应速率的定义式及反应混合物中各种物质间的速率或浓度之间关系的知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
对于反应C(s)+H2O(g)  CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
A.平衡常数表达式为K=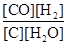 |
| B.增大体系压强,平衡常数K不发生变化 |
| C.升高体系温度,平衡常数K减小 |
| D.增加C(s)的量,平衡正向移动 |
将1.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,一定条件下发生反应:PCl3(g)+ Cl2(g) PCl5(g),达到平衡时PCl5为0.3mol·L-1,如果此时再充入1.0 molPCl3和1.0 mol Cl2,在相同温度下再达到平衡时,PCl5的物质的量浓度是
PCl5(g),达到平衡时PCl5为0.3mol·L-1,如果此时再充入1.0 molPCl3和1.0 mol Cl2,在相同温度下再达到平衡时,PCl5的物质的量浓度是
| A.0.6mol·L-1 | B.大于0.3 mol·L-1,小于0.6 mol·L-1 |
| C.大于0.6 mol·L-1 | D.小于0.3 mol·L-1 |
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是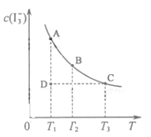
A.反应 I2(aq)+I-(aq) I3-(aq)的ΔH<0 I3-(aq)的ΔH<0 |
B.若温度为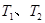 ,反应的平衡常数分别为K1、K2,则K1>K2 ,反应的平衡常数分别为K1、K2,则K1>K2 |
C.若反应进行到状态D时,一定有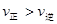 |
| D.状态A与状态B相比,状态A的c(I2)大 |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | | |
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ
活化分子是衡量化学反应速率快慢的重要依据,下列对活化分子说法中不正确的是( )
| A.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
| B.增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快 |
| C.对于有气体参加的反应通过压缩容器增大压强,可使单位体积内活化分子增多,反应速率加快 |
| D.活化分子之间的碰撞一定是有效碰撞 |
 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是