题目内容
1.请写出下列化学反应方程式:(1)2-氯丙烷与氢氧化钠水溶液共热:CH3-CHCl-CH3+NaOH$→_{H_{2}O}^{△}$CH3-CHOH-CH3+NaCl.
(2)1-丙醇与氧气在催化剂作用下反应2CH3CH2CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CH2CHO+2H2O.
分析 (1)2-氯丙烷与氢氧化钠水溶液共热,发生水解反应生成2-丙醇;
(2)1-丙醇与氧气在铜催化作用下反应,醇羟基和醇羟基相连的碳分别脱氢生成醛;
解答 解:(1)2-氯丙烷与氢氧化钠水溶液共热,发生水解反应,羟基取代氯原子,生成2-丙醇,该反应为:CH3-CHCl-CH3+NaOH$→_{H_{2}O}^{△}$CH3-CHOH-CH3+NaCl,
故答案为:CH3-CHCl-CH3+NaOH$→_{H_{2}O}^{△}$CH3-CHOH-CH3+NaCl;
(2)1-丙醇与氧气在铜催化作用下反应生成丙醛,反应的方程式为:2CH3CH2CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CH2CHO+2H2O,
故答案为:2CH3CH2CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CH2CHO+2H2O.
点评 本题考查有机化学反应方程式的书写,为高频考点,把握有机物的结构与性质、有机反应类型为解答的关键,侧重醇、卤代烃性质的考查,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
7.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 4.4g二氧化碳中含有的共用电子对数为0.4NA | |
| B. | 用二氧化硅制取单质硅时,当生成2.24 L气体(标准状况)时,得到2.8 g硅 | |
| C. | 标准状况下,0.5NA 个NO和0.5NA 个O2混合气体的体积约为22.4 L | |
| D. | 常温时0.1 mol•L-1 硝酸铵溶液中,NH4+和H+总数一定大于0.1NA |
9.下列说法正确的是:( )
①液氨汽化时要吸收大量的热,可用作制冷剂
②NO和O2反应生成NO2属于氮的固定
③可用蘸有浓盐酸的棉棒检验输送氨气的管道是否漏气
④检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体.
①液氨汽化时要吸收大量的热,可用作制冷剂
②NO和O2反应生成NO2属于氮的固定
③可用蘸有浓盐酸的棉棒检验输送氨气的管道是否漏气
④检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体.
| A. | ①② | B. | ③④ | C. | ①③ | D. | ①④ |
16.下列说法可以证明反应N2(g)+3H2(g)?2NH3(g)已达到平衡状态的是( )
| A. | 1个N≡N键断裂的同时,有3个H-H键形成 | |
| B. | 1个N≡N键断裂的同时,有3个H-H键断裂 | |
| C. | N2、H2、NH3的分子数之比为1:3:2 | |
| D. | 1个N≡N键断裂的同时,有6个H-N键形成 |
6.未知物A的实验式和分子式都是C2H6O.A的红外光谱图如图(a),未知物A的核磁共振氢谱有三个峰图(b),峰面积之比是1:2:3,未知物A的结构简式为( )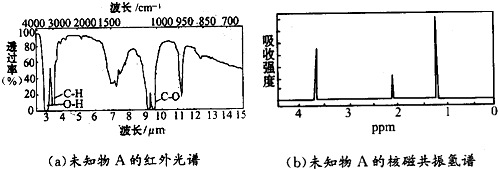

| A. | CH3CH2OH | B. | CH3OCH3 | C. | CH3 COOH | D. | CH3CHO |
10.A和M为两种元素,已知A位于短周期,且A2+与M-的电子数之差为8,则下列说法正确的是( )
| A. | A和M的原子序数之差为6 | |
| B. | A和M原子的最外层电子数之差为7 | |
| C. | A和M原子的最外层电子数之和可能为9 | |
| D. | A和M原子的电子总数之和可能为11 |
11.将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )

| A. | 甲烧杯中锌片逐渐溶解,乙烧杯中锌片不溶解 | |
| B. | 两烧杯中铜片表面均无气泡产生 | |
| C. | 两烧杯中溶液的酸性均减弱 | |
| D. | 甲烧杯中铜片上的电极反应为:Cu2++2e-=Cu |

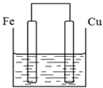 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置(以下均假设反应过程中溶液体积不变).
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置(以下均假设反应过程中溶液体积不变).