题目内容
13.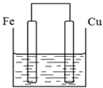 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置(以下均假设反应过程中溶液体积不变).
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置(以下均假设反应过程中溶液体积不变).(1)铁片上的电极反应式为Fe-2e-=Fe2+;
(2)若2min后测得铁片和铜片之间的质量差为1.2g,计算:
①导线中流过的电子的物质的量为0.02mo1;
②该段时间内用硫酸铜表示的平均反应速率为0.01mol•L-1•min-1.
分析 (1)该装置构成原电池,铁易失电子而作负极,铜作正极,铁电极上铁失电子而发生氧化反应;
(2)①负极上铁溶解,正极上析出铜,铁片和铜片相差的质量为溶解铁和析出铜的质量之和,溶解铁的物质的量和析出铜的物质的量相等,根据金属和转移电子之间的关系式计算;
②根据铜离子的物质的量计算平均反应速率.
解答 解:(1)该装置构成原电池,铁易失电子而作负极,铜作正极,铁电极上铁失电子而发生氧化反应,电极反应式为:Fe-2e-=Fe 2+,
故答案为:Fe-2e-=Fe2+;
(2)①设转移xmol电子,则消耗0.5xmolFe,析出0.5xmolCu,则有0.5x×(64+56)=1.2,x=0.02,故答案为:0.02;
②铜离子的平均反应速率=$\frac{\frac{0.2mol}{0.5L}}{2min}$=0.01mol•L-1•min-1,故答案为:0.01.
点评 本题考查原电池知识,侧重于学生的分析能力和计算能力的考查,注意把握原电池的工作原理,把握电极方程式的书写,难度不大.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
4.下列叙述中,正确的是( )
| A. | O2、O3互为同位素 | |
| B. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 | |
| C. | 正丁烷和异丁烷互为同素异形体 | |
| D. | 金刚石、C60互为同分异构体 |
8.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4
④沸点:NH3>ASH3>PH3
⑤晶体的熔点:金刚石>NaCl>CCl4>SO2.
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4
④沸点:NH3>ASH3>PH3
⑤晶体的熔点:金刚石>NaCl>CCl4>SO2.
| A. | ②④⑤ | B. | ①②④ | C. | ③⑤ | D. | 全部正确 |
18.元素周期律和元素周期表是学习化学的重要工具,下列叙述不正确的是( )
| A. | 元素周期表共18列,从左到右的第十七列为卤族元素 | |
| B. | 同一周期元素的原子,半径越小越容易失去电子 | |
| C. | 副族元素全部是金属元素 | |
| D. | 在过渡元素中,人们可以寻找到各种优良的催化剂和高温、耐腐蚀的合金材料 |
5.下列热化学方程式中△H的值能表示可燃物的燃烧热的是( )
| A. | 2H2(g)+2Cl2(g)=4HCl(g)△H=-369、2kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol |
2.①升高温度 ②增大反应物浓度 ③将块状固体反应物磨成粉末 ④减小压强,上述影响化学反应速率的外界因素中,肯定能使化学反应速率加快的是( )
| A. | ①②③④ | B. | 仅①②③ | C. | 仅①③④ | D. | 仅①②④ |
3.下列说法正确的是( )
| A. | Na与水反应时增大水的用量可加快反应速率 | |
| B. | Fe与硫酸反应制取H2时,选用浓硫酸可加快反应速率 | |
| C. | 两支试管中分别加入相同浓度的H2O2溶液,其中一支试管中加少量MnO2,两支试管中产生氧气的快慢相同 | |
| D. | Al在氧气中燃烧生成Al2O3,将铝片改成铝粉燃烧更剧烈 |