题目内容
7.平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质).某课题小组以此粉末为原料,设计如图1工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾: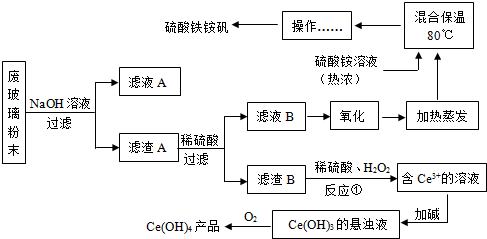
已知:
Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸;
Ⅲ.硫酸铁铵矾[Fe2(SO4)3•(NH4)2SO4•24H2O]广泛用于水的净化处理.
(1)滤液A的主要成分Na2SiO3(填写化学式).
(2)写出反应①的离子方程式2 CeO2+H2O2+6H+═2Ce3++O2↑+4H2O.
(3)反应①之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复2~3次
(4)稀土元素的提纯,还可采用萃取法.已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为Ce2(SO4)3 (水层)+6HT(有机层)?2CeT3(有机层)+3H2SO4(水层),分液得到CeT3 (有机层),再加入H2SO4获得较纯的含Ce3+的水溶液.可选择硫酸作反萃取剂的原因是加入硫酸,可使平衡向左进行,使Ce3+进入水层.
(5)用滴定法测定制得的Ce(OH)4产品纯度.

所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数偏大.(填“偏大”、“偏小”或“无影响”)
(6)已知Fe3+沉淀的pH范围:2.2~3.2,Fe2+沉淀的pH范围:5.8~7.9,Zn2+沉淀的pH范围:5.8~11.0,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.现用FeSO4溶液(含有ZnSO4杂质)来制备硫酸铁铵矾.实验中可选用的试剂:KMnO4溶液、30%H2O2、NaOH溶液、饱和石灰水、稀H2SO4溶液、稀盐酸.
实验步骤依次为:
①向含有ZnSO4杂质的FeSO4溶液中,加入足量的NaOH溶液至pH>11,过滤、洗涤;
②将沉淀溶解在足量的稀硫酸中,并加入适量30%H2O2溶液,充分反应;
③向②中得到的溶液中加入硫酸铵溶液,蒸发浓缩、冷却结晶过滤、洗涤、常温晾干,得硫酸铁铵晶体(NH4) Fe(SO4)2•12H2O.
分析 废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)加入NaOH溶液,SiO2和NaOH溶液反应生成硅酸钠,Fe2O3、CeO2、FeO不反应,然后过滤,滤液A中含有硅酸钠和NaOH,滤渣A中含有Fe2O3、CeO2、FeO;
向滤渣中加入稀硫酸,Fe2O3、FeO溶解生成Fe2(SO4)3、FeSO4,CeO2不溶于稀硫酸,然后过滤,滤液B中含有Fe2(SO4)3、FeSO4和硫酸,滤渣B中含有CeO2;
将滤液B氧化得到硫酸铁,然后加热蒸发并加入硫酸铵,通过蒸发浓缩、冷却结晶得到硫酸铁铵钒;
将滤渣B加入稀硫酸和双氧水,Ce4+有较强氧化性,能将双氧水氧化为氧气,自身被还原得到Ce3+,向溶液中加入碱得到Ce(OH)3悬浊液,将Ce(OH)3氧化得到Ce(OH)4;
(1)滤液A的主要成分为硅酸钠;
(2)反应①为 CeO2和H2O2的氧化还原反应;
(3)洗涤沉淀的方法是:沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复2~3次;
(4)生成物浓度增大,平衡逆向移动;
(5)所用FeSO4溶液在空气中露置一段时间后再进行滴定,导致硫酸亚铁溶液体积增大,则测得该Ce(OH)4产品的质量分数增大;
(6)①分离难溶性固体和溶液采用过滤方法,将沉淀洗涤得到较纯净的物质;
②将硫酸亚铁氧化得到硫酸铁;
③向②中得到的溶液中加入硫酸铵溶液,从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤、常温晾干的方法.
解答 解:废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)加入NaOH溶液,SiO2和NaOH溶液反应生成硅酸钠,Fe2O3、CeO2、FeO不反应,然后过滤,滤液A中含有硅酸钠和NaOH,滤渣A中含有Fe2O3、CeO2、FeO;
向滤渣中加入稀硫酸,Fe2O3、FeO溶解生成Fe2(SO4)3、FeSO4,CeO2不溶于稀硫酸,然后过滤,滤液B中含有Fe2(SO4)3、FeSO4和硫酸,滤渣B中含有CeO2;
将滤液B氧化得到硫酸铁,然后加热蒸发并加入硫酸铵,通过蒸发浓缩、冷却结晶得到硫酸铁铵钒;
将滤渣B加入稀硫酸和双氧水,Ce4+有较强氧化性,能将双氧水氧化为氧气,自身被还原得到Ce3+,向溶液中加入碱得到Ce(OH)3悬浊液,将Ce(OH)3氧化得到Ce(OH)4;
(1)只有二氧化硅能溶于NaOH溶液,所以滤液A的主要成分为Na2SiO3,故答案为:Na2SiO3;
(2)反应①为 CeO2和H2O2的氧化还原反应,双氧水被氧化生成氧气,离子反应方程式为2 CeO2+H2O2+6H+═2Ce3++O2↑+4 H2O,
故答案为:2 CeO2+H2O2+6H+═2Ce3++O2↑+4 H2O;
(3)洗涤沉淀的方法是:沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复2~3次,从而得到较纯净的沉淀沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复2~3次,故答案为:沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复2~3次;
(4)加入硫酸,可使平衡向左进行,使Ce3+进入水层,所以可选择硫酸作反萃取剂,故答案为:加入硫酸,可使平衡向左进行,使Ce3+进入水层;
(5)所用FeSO4溶液在空气中露置一段时间后再进行滴定,部分亚铁离子被氧化生成铁离子,则硫酸亚铁浓度降低,导致硫酸亚铁溶液体积增大,所以测得该Ce(OH)4产品的质量分数偏大,故答案为:偏大;
(6)①分离难溶性固体和溶液采用过滤方法,将沉淀洗涤得到较纯净的物质,亚铁离子和氢氧根离子反应生成沉淀,锌离子和过量氢氧根离子生成偏锌酸根离子,然后采用过滤方法分离,故答案为:过滤;洗涤;
②硫酸铁和硫酸铵混合得到硫酸铁铵钒,所以将沉淀溶解在足量的稀硫酸中,并加入适量30%H2O2溶液,充分反应得到硫酸铁溶液,故答案为:将沉淀溶解在足量的稀硫酸中,并加入适量30%H2O2溶液,充分反应;
③向②中得到的溶液中加入硫酸铵溶液,从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤、常温晾干的方法,从而得到晶体,故答案为:蒸发浓缩;冷却结晶.
点评 本题考查物质分离和提纯,为高频考点,涉及物质分离和提纯方法选取、晶体获取方法、氧化还原反应等知识点,明确反应原理是解本题关键,知道流程图中发生的反应及基本操作方法,题目难度中等.

| A. | 化学反应速率可用单位时间内反应物或生成物的物质的量的变化表示 | |
| B. | 硫代硫酸钠与酸反应,一定产生淡黄色的浑浊现象 | |
| C. | 相同物质的量浓度的硫代硫酸钠与稀盐酸反应,其他条件不变,盐酸浓度越大,产生淡黄色浑浊越快 | |
| D. | 相同物质的量浓度的硫代硫酸钠与稀硫酸反应,温度越高,产生淡黄色浑浊越快 |
| A. | 由X,Y,Z组成的盐的水溶液中阳离子总浓度大于阴离子总浓度 | |
| B. | YX3的水溶液呈弱碱性,能使湿润的蓝色石蕊试纸变红 | |
| C. | X与Z形成的化合物的水溶液可用于雕刻玻璃 | |
| D. | W的氯化物熔点低,易升华,但其水溶液能导电,由此推断它属于弱电解质 |
 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有一个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和EO两种氧化物 |
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1;
(2)C元素的第一电离能比氧元素的第一电离能大 (填“大”或“小”);
(3)CA3分子中C原子的杂化轨道类型是sp3;
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有①③ (填序号)
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a (填序号);
a.平面正方形 b.正四面体 c.三角锥型 d.V型
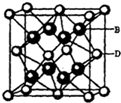
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$cm3 (写出表达式即可).
| A. | 化学反应的限度都相同 | |
| B. | 化学反应的限度可以改变 | |
| C. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| D. | 当一个化学反应在一定条件下达到限度时,反应即停止 |
 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷;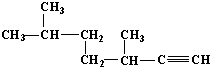 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔; ;
; ,分子式为C15H22O2;
,分子式为C15H22O2;  中含有的官能团的名称为羟基,酯基.
中含有的官能团的名称为羟基,酯基.