题目内容
12. (1)现有如下两个反应:①NaOH+HCl=NaCl+H2O,②Fe+H2SO4=FeSO4+H2↑.
(1)现有如下两个反应:①NaOH+HCl=NaCl+H2O,②Fe+H2SO4=FeSO4+H2↑.两反应中为放热反应的是①②,能设计成原电池的是②.(填序号)
(2)根据如图填空①电子从Zn片流出,溶液中H+向Cu片移动.
②正极的现象是有气泡产生,发生还原反应(填写“氧化”或“还原”).
③负极的电极方程式为Zn-2e-═Zn2+.
④若反应过程中有0.01mol电子发生转移,则生成的氢气在标准状况下的体积为0.112L.
分析 (1)酸碱中和反应和活泼金属与酸的反应都是放热反应;要构成原电池必须能自发的氧化还原反应;
(2)①原电池中电子从活泼的负极沿导线流向正极;阳离子向正极移动;
②铜是正极,发生还原反应,电极反应式为:2H++2e-=H2↑;
③负极发生氧化反应,电极反应式为:Zn-2e-═Zn2+;
④电路中移转2mol的电子生成的氢气在标准状况下的体积为22.4L,以此分析解答.
解答 解:(1)酸碱中和反应和活泼金属与酸的反应都是放热反应,所以①②都是放热反应;要构成原电池必须能自发的氧化还原反应,NaOH+HCl=NaCl+H2O是非氧化还原反应,而Fe+H2SO4=FeSO4+H2↑是氧化还原反应,故答案为:①②;②;
(2)由图锌是负极,负极发生氧化反应,电极反应式为:Zn-2e-═Zn2+;铜是正极,发生还原反应,电极反应式为:2H++2e-=H2↑,
①电子从锌Zn片流出,溶液中H+向铜,故答案为:Zn;Cu;
②铜是正极,发生还原反应,电极反应式为:2H++2e-=H2↑,所以现象有气泡产生,故答案为:有气泡产生;还原;
③负极发生氧化反应,电极反应式为:Zn-2e-═Zn2+,故答案为:Zn-2e-═Zn2+;
④电路中移转2mol的电子生成的氢气在标准状况下的体积为22.4L,所以有0.01mol电子发生转移,生成标况的体积为0.112L,故答案为:0.112.
点评 本题考查原电池原理,侧重考查电极反应式书写、电子流向及阴阳离子移动方向等知识点,电解质溶液中阴阳离子移动方向是学习难点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的是( )
| 物质 | 杂质 | 除杂试剂或操作方法 | |
| A. | FeSO4 | CuSO4 | 加入过量铁粉,过滤 |
| B. | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
| C. | NaCl溶液 | I2 | 加酒精,萃取分液 |
| D. | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
20.四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的三倍.请用化学用语回答:
(1)丙在元素周期表中的位置第三周期第VIA族
(2)乙的两种常见单质分别是O2、O3
(3)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)H2S,HCl
(4)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)H2O2.此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式H2O2+CN-+OH-=CO32-+NH3
(5)实验室制备丁单质的离子方程式4H+(浓)+2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑
(6)若甲的元素符号为X.
已知:①X2(g)+2O2(g)═X2O4(l)△H=-19.5KJ/mol
②X2H4(l)+O2(g)═X2(g)+2H2O(g)△H=-534.2KJ/mol
则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
| 甲 | 乙 | |
| 丙 | 丁 |
(2)乙的两种常见单质分别是O2、O3
(3)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)H2S,HCl
(4)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)H2O2.此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式H2O2+CN-+OH-=CO32-+NH3
(5)实验室制备丁单质的离子方程式4H+(浓)+2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑
(6)若甲的元素符号为X.
已知:①X2(g)+2O2(g)═X2O4(l)△H=-19.5KJ/mol
②X2H4(l)+O2(g)═X2(g)+2H2O(g)△H=-534.2KJ/mol
则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
7.下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题.
(1)化学性质最不活泼的元素是?Ne(填元素符号).
(2)镁的原子结构示意图为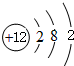 .
.
(3)N与O原子半径较大的是N.
(4)H2SO4与HClO4中,酸性较强的是HClO4.
(5)NaOH与Al(OH)3中,属于两性氢氧化物的是,它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)Si是良好的半导体材料,它的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料).
(7)碳元素形成的一种氧化物的化学式是?CO或CO2,该物质中C元素与O元素的质量比为3:4或3:8?.(相对原子质量:C-12 O-16)
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)镁的原子结构示意图为
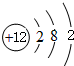 .
.(3)N与O原子半径较大的是N.
(4)H2SO4与HClO4中,酸性较强的是HClO4.
(5)NaOH与Al(OH)3中,属于两性氢氧化物的是,它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)Si是良好的半导体材料,它的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料).
(7)碳元素形成的一种氧化物的化学式是?CO或CO2,该物质中C元素与O元素的质量比为3:4或3:8?.(相对原子质量:C-12 O-16)
4.下列说法正确的是( )
| A. | NaHSO4无论在水溶液或熔融状态下都可以电离出Na+、H+和SO42- | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | H2SO4在电流作用下在水中电离出H+和SO42- | |
| D. | 液态HCl,固态NaCl均不导电,所以HCl、NaCl都不是电解质 |
2.下列能层中,原子轨道的数目为9的是( )
| A. | K层 | B. | L层 | C. | M层 | D. | N层 |
 .C、D还可形成化合物D2C2,D2C2含有的化学键是离子键、非极性共价键(或离子键、共价键).
.C、D还可形成化合物D2C2,D2C2含有的化学键是离子键、非极性共价键(或离子键、共价键).