题目内容
10.如图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格: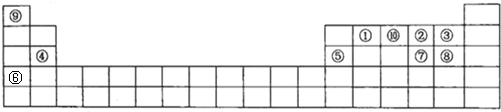
(1)在这10种元素中金属性最强的是F(填元素符号);
(2)元素②与⑨形成的18e-化合物的电子式
 ;
;①②按原子个数比1:2形成的化合物结构式为O=C=O
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有离子键、共价键.
分析 由元素在周期表中位置,可知①为C、②为O、③为F、④为Mg、⑤为Al、⑥为K、⑦为S、⑧为Cl、⑨为H、⑩为N.
(1)同周期自左而右元素非金属性增强,同主族自上而下元素非金属性减弱;
(2)元素②与⑨形成的18e-化合物为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对;元素①②按原子个数比1:2形成的化合物为二氧化碳,分子中O原子与C原子形成两对共价键;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3.
解答 解:由元素在周期表中位置,可知①为C、②为O、③为F、④为Mg、⑤为Al、⑥为K、⑦为S、⑧为Cl、⑨为H、⑩为N.
(1)同周期自左而右元素非金属性增强,同主族自上而下元素非金属性减弱,故上述元素中F元素非金属性最强,为③号元素,故答案为:F;
(2)元素②与⑨形成的18e-化合物为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,其电子式为: ,C与O形成的原子个数比为1:2的化合物为二氧化碳,为直线形分子,结构式为O=C=O,故答案为:
,C与O形成的原子个数比为1:2的化合物为二氧化碳,为直线形分子,结构式为O=C=O,故答案为: ;O=C=O;
;O=C=O;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3,含有离子键、共价键,故答案为:离子键、共价键.
点评 本题考查元素周期表与元素周期律,难度不大,侧重对元素周期律与化学用语的考查,注意掌握用电子式表示物质或化学键的形成.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
20.四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的三倍.请用化学用语回答:
(1)丙在元素周期表中的位置第三周期第VIA族
(2)乙的两种常见单质分别是O2、O3
(3)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)H2S,HCl
(4)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)H2O2.此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式H2O2+CN-+OH-=CO32-+NH3
(5)实验室制备丁单质的离子方程式4H+(浓)+2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑
(6)若甲的元素符号为X.
已知:①X2(g)+2O2(g)═X2O4(l)△H=-19.5KJ/mol
②X2H4(l)+O2(g)═X2(g)+2H2O(g)△H=-534.2KJ/mol
则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
| 甲 | 乙 | |
| 丙 | 丁 |
(2)乙的两种常见单质分别是O2、O3
(3)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)H2S,HCl
(4)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)H2O2.此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式H2O2+CN-+OH-=CO32-+NH3
(5)实验室制备丁单质的离子方程式4H+(浓)+2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑
(6)若甲的元素符号为X.
已知:①X2(g)+2O2(g)═X2O4(l)△H=-19.5KJ/mol
②X2H4(l)+O2(g)═X2(g)+2H2O(g)△H=-534.2KJ/mol
则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
18.今年3月11日,在日本大地震灾难中,福岛核电站泄漏的放射性物质中含有${\;}_{53}^{131}$I,下列有关说法正确的是( )
| A. | ${\;}_{53}^{131}$I元素中含中子数为53 | |
| B. | 它是碘元素的一种同位素 | |
| C. | ${\;}_{53}^{131}$I2的摩尔质量为262 g | |
| D. | 由此可确定碘元素相对原子质量为131 |
5.除去物质中所含少量杂质(括号内为杂质),所选用试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 溴苯(液溴) | NaOH溶液 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
15.能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是( )
| A. | Cl2、Br2、I2的熔点 | B. | Cl2、Br2、I2的相对分子质量 | ||
| C. | HCl、HBr、HI的酸性 | D. | 氢化物HCl、HBr、HI的热稳定性 |
2.下列能层中,原子轨道的数目为9的是( )
| A. | K层 | B. | L层 | C. | M层 | D. | N层 |
20.下列各电离方程式中,书写正确的是( )
| A. | Al(OH)3═Al3++3OH- | B. | KHSO4═K++H++SO${\;}_{4}^{2-}$ | ||
| C. | CH3COOH?H++CH3COO- | D. | NaH2PO4?Na++H2PO${\;}_{4}^{-}$ |

