题目内容
15.已知:共轭二烯烃(如1,3-丁二烯)可以发生如下两种加成反应:CH2=CH-CH=CH2

请以苯酚为原料,其他无机试剂任选,合成
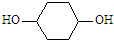 ,写出正确的合成路线:
,写出正确的合成路线: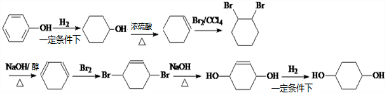 .
.
分析 以苯酚为原料,其他无机试剂任选,合成 ,先用苯酚和氢气发生加成反应生成环己醇,环己醇再和浓硫酸混合加热发生消去反应生成环己烯,环己烯和溴发生加成反应生成1,2-二溴环己烷,1,2-二溴环己烷和NaOH的醇溶液加热发生消去反应生成1,3-环己二烯,1,3-环己二烯和溴在较低温度下发生1,4加成生成1,4-二溴-2-环己烯,1,4-二溴-2-环己烯和NaOH的水溶液发生取代反应生成
,先用苯酚和氢气发生加成反应生成环己醇,环己醇再和浓硫酸混合加热发生消去反应生成环己烯,环己烯和溴发生加成反应生成1,2-二溴环己烷,1,2-二溴环己烷和NaOH的醇溶液加热发生消去反应生成1,3-环己二烯,1,3-环己二烯和溴在较低温度下发生1,4加成生成1,4-二溴-2-环己烯,1,4-二溴-2-环己烯和NaOH的水溶液发生取代反应生成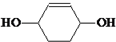 ,
, 和氢气发生加成反应生成
和氢气发生加成反应生成 ,据此分析解答.
,据此分析解答.
解答 解:以苯酚为原料,其他无机试剂任选,合成 ,先用苯酚和氢气发生加成反应生成环己醇,环己醇再和浓硫酸混合加热发生消去反应生成环己烯,环己烯和溴发生加成反应生成1,2-二溴环己烷,1,2-二溴环己烷和NaOH的醇溶液加热发生消去反应生成1,3-环己二烯,1,3-环己二烯和溴在较低温度下发生1,4加成生成1,4-二溴-2-环己烯,1,4-二溴-2-环己烯和NaOH的水溶液发生取代反应生成
,先用苯酚和氢气发生加成反应生成环己醇,环己醇再和浓硫酸混合加热发生消去反应生成环己烯,环己烯和溴发生加成反应生成1,2-二溴环己烷,1,2-二溴环己烷和NaOH的醇溶液加热发生消去反应生成1,3-环己二烯,1,3-环己二烯和溴在较低温度下发生1,4加成生成1,4-二溴-2-环己烯,1,4-二溴-2-环己烯和NaOH的水溶液发生取代反应生成 ,
, 和氢气发生加成反应生成
和氢气发生加成反应生成 ,其流程图为
,其流程图为 ,
,
故答案为: .
.
点评 本题考查有机物合成,为高考高频点,侧重考查学生知识运用能力,明确常见有机物官能团及其性质、常见反应类型、反应条件即可解答,可以根据目标采用采用逆向思维方法进行判断,题目难度中等.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
20.四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的三倍.请用化学用语回答:
(1)丙在元素周期表中的位置第三周期第VIA族
(2)乙的两种常见单质分别是O2、O3
(3)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)H2S,HCl
(4)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)H2O2.此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式H2O2+CN-+OH-=CO32-+NH3
(5)实验室制备丁单质的离子方程式4H+(浓)+2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑
(6)若甲的元素符号为X.
已知:①X2(g)+2O2(g)═X2O4(l)△H=-19.5KJ/mol
②X2H4(l)+O2(g)═X2(g)+2H2O(g)△H=-534.2KJ/mol
则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
| 甲 | 乙 | |
| 丙 | 丁 |
(2)乙的两种常见单质分别是O2、O3
(3)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)H2S,HCl
(4)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)H2O2.此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式H2O2+CN-+OH-=CO32-+NH3
(5)实验室制备丁单质的离子方程式4H+(浓)+2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑
(6)若甲的元素符号为X.
已知:①X2(g)+2O2(g)═X2O4(l)△H=-19.5KJ/mol
②X2H4(l)+O2(g)═X2(g)+2H2O(g)△H=-534.2KJ/mol
则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
7.下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题.
(1)化学性质最不活泼的元素是?Ne(填元素符号).
(2)镁的原子结构示意图为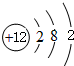 .
.
(3)N与O原子半径较大的是N.
(4)H2SO4与HClO4中,酸性较强的是HClO4.
(5)NaOH与Al(OH)3中,属于两性氢氧化物的是,它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)Si是良好的半导体材料,它的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料).
(7)碳元素形成的一种氧化物的化学式是?CO或CO2,该物质中C元素与O元素的质量比为3:4或3:8?.(相对原子质量:C-12 O-16)
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)镁的原子结构示意图为
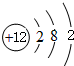 .
.(3)N与O原子半径较大的是N.
(4)H2SO4与HClO4中,酸性较强的是HClO4.
(5)NaOH与Al(OH)3中,属于两性氢氧化物的是,它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)Si是良好的半导体材料,它的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料).
(7)碳元素形成的一种氧化物的化学式是?CO或CO2,该物质中C元素与O元素的质量比为3:4或3:8?.(相对原子质量:C-12 O-16)
4.下列说法正确的是( )
| A. | NaHSO4无论在水溶液或熔融状态下都可以电离出Na+、H+和SO42- | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | H2SO4在电流作用下在水中电离出H+和SO42- | |
| D. | 液态HCl,固态NaCl均不导电,所以HCl、NaCl都不是电解质 |
5.除去物质中所含少量杂质(括号内为杂质),所选用试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 溴苯(液溴) | NaOH溶液 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
 ,取代反应;
,取代反应; ,加聚反应.
,加聚反应. .C、D还可形成化合物D2C2,D2C2含有的化学键是离子键、非极性共价键(或离子键、共价键).
.C、D还可形成化合物D2C2,D2C2含有的化学键是离子键、非极性共价键(或离子键、共价键). 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答: CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.