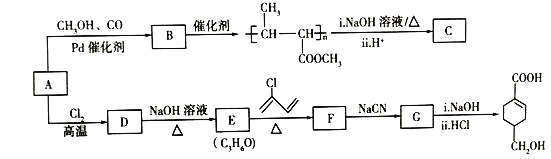
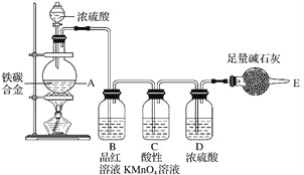
题目内容
【题目】己知下列物质的K:CaCO35×10-9;BaSO41×10-10:BaCO35×10-8:Mg(OH)25.6×10-12;Ca(OH)21.4×10-5,氯碱工业中,电解所用的饱和食盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+),精制流程如下(注:溶液A为NaOH溶液)
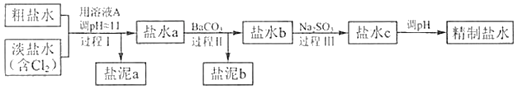
①盐泥a除泥沙外,还含有的物质是___。
②过程Ⅰ中将NH4+转化为N2的离子方程式是___。
⑨过程Ⅱ中除去的离子有___。
【答案】Mg(OH)2 2NH4++3Cl2+8OH-=N2+6Cl-+8H2O SO42-、Ca2+
【解析】
粗盐水与淡盐水混合,发生两个反应,一个是Cl2与NH4+的氧化还原反应(生成N2、Cl-等),另一个是Mg2+与OH-的反应(生成氢氧化镁沉淀),可由溶度积常数进行计算确认;盐水a中加入BaCO3,可通过溶度积常数的比较,确定生成BaSO4、CaCO3沉淀;盐水b中加入Na2SO3,与Cl2发生氧化还原反应(生成SO42-、Cl-等);盐水c中调pH,可去除大部分OH-,得到精制盐水。
①pH=11,c(OH-)=10-3mol/L,c(Mg2+)=![]() =5.6×10-6mol/L,c(Ca2+)=
=5.6×10-6mol/L,c(Ca2+)=![]() =14mol/L,由此可确定,溶液中的Mg2+完全沉淀,而Ca2+大量存在;因此,盐泥a除泥沙外,还含有的物质是Mg(OH)2。答案为:Mg(OH)2;
=14mol/L,由此可确定,溶液中的Mg2+完全沉淀,而Ca2+大量存在;因此,盐泥a除泥沙外,还含有的物质是Mg(OH)2。答案为:Mg(OH)2;
②由分析可知,过程Ⅰ中将NH4+转化为N2,需使用Cl2作氧化剂,离子方程式是2NH4++3Cl2+8OH-=N2+6Cl-+8H2O。答案为:2NH4++3Cl2+8OH-=N2+6Cl-+8H2O;
⑨过程Ⅱ中,盐水a中加入BaCO3,比较三者的Ksp:CaCO3为5×10-9、BaSO4为1×10-10、BaCO3为5×10-8,可以看出,CaCO3、BaSO4的Ksp都比BaCO3的Ksp小,所以溶液中的Ca2+、SO42-都与BaCO3发生反应,转化为沉淀除去,故过程Ⅱ除去的离子有SO42-、Ca2+。答案为:SO42-、Ca2+。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案