题目内容
【题目】某兴趣小组用铝箔制备纳米Al2O3、AlCl3·6H2O及铵明矾晶体(NH4Al(SO4)212H2O,摩尔质量为453gmol-1),具体流程如图:

已知:a.AlCl3·6H2O易溶于水、乙醇及乙醚;
b.铵明矾晶体无色、透明,可溶于水、不溶于乙醇。120℃时失去结晶水,280℃以上分解。
请回答:
(1)步骤Ⅰ的离子方程式为______。
(2)下列操作或描述正确的是_____。
A.步骤IV制备铵明矾利用了物质的溶解度差异
B.步骤III灼烧时需将氢氧化铝放在蒸发皿里用高温炉灼烧至恒重
C.步骤II生成的固体可用抽滤法分离,为加快过滤速度,可用玻璃棒轻轻搅拌
D.步骤IV中可以选择乙醇洗涤晶体,如果在常压下快速干燥,温度选择低于120℃
(3)由溶液A制备AlCl3·6H2O的过程中要通入HCl气体,其作用是______(写两条)。
(4)步骤V抽滤时不能用滤纸,原因是_____。若用如图装置图进行抽滤,则抽滤结束时应进行的操作是______。

(5)用电子天平称取2.760g的铵明矾粗产品,用水溶解后取相同体积的两份溶液。第一份用EDTA滴定法测得n(Al3+)为0.002900mol;第二份用BaCl2溶液滴定法测得n(SO42-)为0.006300mol。则该试样中铵明矾的纯度为______。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ AD 抑制氯化铝的水解;增大Cl-的浓度,有利于AlCl36H2O晶体形成 溶液呈酸性会腐蚀滤纸 先打开安全瓶上的活塞,再关闭抽气泵,最后取下玻璃砂漏斗 95.20%
【解析】
Al和NaOH溶液反应得到NaAlO2,NaAlO2溶液通入过量CO2得到Al(OH)3胶状沉淀,过滤除去滤液得到Al(OH)3胶状固体,Al(OH)3受热分解得到Al2O3。Al(OH)3和硫酸反应得硫酸铝,硫酸铝和硫酸铵混合后根据溶解度差异析出硫酸铝铵,经过滤、洗涤、干燥得铵明矾晶体[NH4Al(SO4)212H2O]。Al(OH)3和HCl反应得AlCl3溶液,为抑制AlCl3水解,在AlCl3溶液中通入HCl后抽滤、洗涤、干燥得AlCl3·6H2O,据此解答。
(1)步骤Ⅰ为Al和NaOH溶液反应生成NaAlO2和H2,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)A.步骤IV中,只有NH4Al(SO4)2溶解度比硫酸铵、硫酸铝小,才能析出硫酸铝铵晶体,A正确;
B.灼烧在坩埚中而不是蒸发皿中进行,B错误;
C.氢氧化铝能形成胶体,沉淀颗粒非常微小,抽滤的话,胶粒会穿透滤纸造成损失,用玻璃棒搅拌可能造成滤纸破损,氢氧化铝损失更严重,C错误;
D.铵明矾可溶于水、不溶于乙醇,故用乙醇洗涤,高于120℃时铵明矾失去结晶水,故温度应低于120℃,D正确;
答案选AD;
(3)氯化铝会水解:AlCl3+3H2O![]() Al(OH)3+3HCl,通入HCl气体可抑制氯化铝水解。同时:AlCl36H2O(s)
Al(OH)3+3HCl,通入HCl气体可抑制氯化铝水解。同时:AlCl36H2O(s)![]() Al3+(aq)+3Cl-(aq)+6H2O(l),增大Cl-的浓度,有利于AlCl36H2O晶体形成,故答案为:抑制氯化铝的水解;增大Cl-的浓度,有利于AlCl36H2O晶体形成;
Al3+(aq)+3Cl-(aq)+6H2O(l),增大Cl-的浓度,有利于AlCl36H2O晶体形成,故答案为:抑制氯化铝的水解;增大Cl-的浓度,有利于AlCl36H2O晶体形成;
(4)AlCl3溶液显酸性,会腐蚀滤纸,故步骤V抽滤时不能用滤纸,可用玻璃砂漏斗,抽滤结束时,应先打开活塞恢复常压,然后关闭抽气泵,最后取下玻璃砂漏斗,故答案为:溶液呈酸性会腐蚀滤纸;先打开安全瓶上的活塞,再关闭抽气泵,最后取下玻璃砂漏斗;
(5)样品平均分成2份,第一份中:n(Al3+)=0.002900mol,第二份中:n(SO42-)=0.006300mol, n(SO42-)>2n(Al3+),则每份中:n[NH4Al(SO4)212H2O]=n(Al3+)=0.002900mol,m[NH4Al(SO4)212H2O]=0.002900mol×453gmol-1=1.3137g,故样品中铵明矾的纯度=![]() ≈95.20%,故答案为:95.20%。
≈95.20%,故答案为:95.20%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
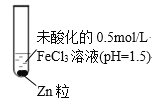
小学生10分钟应用题系列答案【题目】某小组同学为探究Zn与FeCl3溶液的反应,设计并完成了如下实验。
| 实验 | 条件 | 现象 |
ⅰ | 18℃ | 无明显气泡,0.5 min后有气体产生,一段时间后,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 | |
ⅱ | 65℃水浴 | 有气泡产生,12 s后,气泡非常明显,溶液很快转为红棕色,一段时间后,红棕色消失,最后产生红棕色沉淀 |
(1)实验ⅰ和ⅱ中均有气体产生,该气体为 ________。
(2)实验ⅱ中产生气体的速率明显快于实验ⅰ,可能的原因是________。
(3)“加铁氰化钾溶液有蓝色沉淀生成”说明混合溶液中存在________。
(4)实验ⅰ和ⅱ均先有气体生成,后有溶液颜色的变化。研究小组猜想,可能是此实验条件下,氧化性H+>Fe3+。
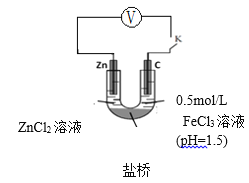
查阅资料:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。根据资料小组同学设计了如下对比实验。
实验ⅲ | 实验ⅳ |
| _____________ |
①请在表格中画出实验ⅳ的装置图 。
②进行对比实验,观察到________,得出氧化性:Fe3+>H+。
研究小组进一步分析后,将Zn粒改为Zn粉,继续进行实验。
实验 | 条件 | 现象 |
ⅴ | 18℃,混合后不振荡 | 3 min后有明显的气泡产生,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
ⅵ | 18℃,混合后振荡 | 气泡不明显,红棕色褪色明显,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
③对比实验ⅴ和ⅵ,解释“气泡不明显,红棕色褪色明显”的可能原因:________。
(5)结合实验探究过程及现象,影响Zn与FeCl3溶液的反应过程的条件有________。