题目内容
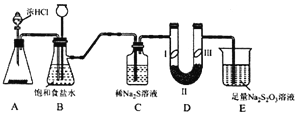
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是


A. Ⅰ图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B. Ⅱ图中:闻Cl2的气味
C. Ⅲ图中:生成棕黄色的烟
D. Ⅳ图中:若气球干瘪,证明Cl2可与NaOH反应
【答案】D
【解析】
A.由Ⅰ图中实验现象可知:干燥的氯气不能使有色布条褪色,说明氯气没有漂白性,而能使湿润的有色布条褪色,说明氯气与水反应的生成物具有漂白性,故A说法正确;
B.Cl2有毒,闻其气味时应用手轻轻在瓶口扇动,仅使极少量气体飘入鼻孔中,故B说法正确;
C.Cu丝在Cl2中燃烧生成棕黄色的烟,故C说法正确;
D.若Cl2能与NaOH溶液反应,烧瓶内压强减小,气球就会鼓起,故D说法错误;
答案选D。

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目