题目内容
【题目】研究氮、硫、碳及其化合物的转化对于环境的改善有重大意义,可减少如雾霾天气、酸雨、酸雾等环境污染问题。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2 (g)△H=____kJ·mol-1;
CO2(g)+2H2O(g)+N2 (g)△H=____kJ·mol-1;
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g)。在一定温度和压强下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强在不同温度下与反应时间如图1所示。
2SO3(g)。在一定温度和压强下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强在不同温度下与反应时间如图1所示。

① 图1中C点时,SO2的转化率为_______。
② 图1中B点的压强平衡常数Kp=_______。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)已知4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH1=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图2所示。
5N2(g)+6H2O(g) ΔH1=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图2所示。

①与容器a中的反应相比,容器b中的反应改变的实验条件可能是_______,判断的依据是______________________________________。
②一定温度下,下列能说明反应已达到平衡状态的是____
A.H2O(g)与NO的生成速率相等 B.混合气体的密度保持不变
C.ΔH保持不变 D.容器的总压强保持不变
(4)利用人工光合作用,借助太阳能使CO2和H2O转化为HCOOH,如图3所示,在催化剂b表面发生的电极反应为:_____________________________________。
【答案】 -875.3 66% 24300 升高温度 容器b中反应达到平衡所需时间比容器a短,且平衡时c(N2)也比容器a小,平衡逆向移动 AD CO2+2H++2e-=HCOOH
【解析】(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
根据盖斯定律①-②-③×2可得:CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2 (g) △H=(-890.3kJmol-1)-(67.0kJmol-1)-(-41.0kJmol-1)×2=-875.3kJmol-1;
CO2(g)+2H2O(g)+N2 (g) △H=(-890.3kJmol-1)-(67.0kJmol-1)-(-41.0kJmol-1)×2=-875.3kJmol-1;
(2)①依据化学三行列式计算,设氧气消耗物质的量为x,
2SO2(g)+O2(g)2SO3
起始量(mol) 2a a 0
变化量(mol) 2x x 2x
平衡量(mol)2a﹣2x a﹣x 2x
图中A点时,气体物质的量0.078,则![]() =
=![]() ,x=0.66a,SO2的转化率=
,x=0.66a,SO2的转化率=![]() ×100%=66%;②图中B点,依据化学三行列式计算,设氧气消耗物质的量为y,
×100%=66%;②图中B点,依据化学三行列式计算,设氧气消耗物质的量为y,
2SO2(g)+O2(g)2SO3
起始量(mol) 2a a 0
变化量(mol) 2y y 2y
平衡量(mol)2a﹣2y a﹣y 2y
B点气体物质的量为 0.007,则![]() =
=![]() ,y=0.9a,
,y=0.9a,
平衡常数K=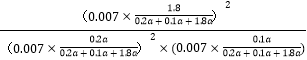 =24300(MPa)﹣1;
=24300(MPa)﹣1;
(3)①容器b中反应达到平衡所需时间比容器a短,且平衡时c(N2)也比容器a小,平衡逆向移动,故与容器a中的反应相比,容器b中的反应改变的实验条件可能升高温度;②A.H2O(g)与NO的生成速率相等,说明正逆反应速率相等,反应达到平衡状态;B.反应在恒容条件下进行且参与反应的气体总质量不变,则混合气体的密度始终保持不变,混合气体的密度保持不变不能说明达到平衡状态;C.ΔH与化学方程式中各物质系数、状态、反应时温度有关,可逆反应的焓变是完全反应时的焓变,所以不能证明反应过平衡;D.反应为气体体积减小的反应,当容器的总压强保持不变说明反应达到平衡状态;答案选AD;(4)由图示知,电子由催化剂a表面流向催化剂b表面,说明催化剂a为负极,催化剂b为正极,二氧化碳在催化剂b表面发生还原反应结合H+生成HCOOH,电极反应为CO2+2H++2e-=HCOOH。




