��Ŀ����
����Ŀ��ij��ѧѧϰС�������ͼʵ��װ��(�д�װ����ȥ)�Ʊ�Cl2����̽��������������ʡ�
��֪: ���������(Na2S2O3)��Һ�ڹ�ҵ�Ͽ������ȼ���
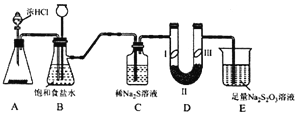
(1)��Aװ���й���ҩƷΪKMnO4�����������3.36L����ʱ����������HCl�����ʵ���Ϊ___��
(2)װ��B��������_____________��
(3)װ��C��������̽��������Na2S��Һ��Ӧ����Ӧ��ʼ�۲쵽C�в�����ɫ������д���÷�Ӧ�Ļ�ѧ����ʽ_____________��
(4)װ��D����������֤�����Ƿ����Ư���ԣ�I����ʪ�����ɫ��������II��III��Ӧ��������ʷֱ���__________��____________��
��̽���뷴˼��
��ͼ�����װ�ý���ʵ�飬��ͬѧ�۲쵽C���Ȳ�����ɫ���������dz�ʱ��ͨ����������Һ�ֱ���壬��ͬѧ˼�����������ʵ�����C��������ijɷ֡�
ʵ���������:
��ȡ����ԭNa2S��Һ��С�Թ��У��μ�BaCl2��Һ��������������
��ȡ������Ӧ��C�г�����Һ��С�Թ��У��μӹ��������ᣬ������ð�����ٵμ�BaCl2��Һ��������ɫ������
(5)��ͬѧ����ʵ������ó�����:װ��C �����ɵĺ���Ԫ�ص�������______ (�ѧʽ)���Ʋ������������Na2S��Һ��Ӧ�����ӷ���ʽΪ________________��
(6)�������ӷ���ʽ˵��װ��E������______________��
(7)��ͬѧ����˼������Ϊװ��E�е��Լ����������������ӷ���ʽ�ͱ�Ҫ�����ֽ���ԭ��:________________________________��
���𰸡� 0.30 mol ��ȥ�����е��Ȼ��⣬ƽ��ѹǿ Cl2+Na2S==2NaCl+S�� ��ˮ������(��轺��P2O5) �������ɫ���� Na2SO4 S2-+ 4Cl2 + 4H2O=SO42- + 8Cl-+ 8H+ S2O32- + 4Cl2 + 5H2O=2SO42- + 8Cl-+ 10H+ ��Ϊ������������Һ�в���������H+����������Na2S2O3������ӦS2O32-+2H+=S ��+SO2 ��+H2O�������ж����壬��Ⱦ������
��������(1)��Aװ���й���ҩƷΪKMnO4�������ᷴӦ�Ļ�ѧ����ʽΪ��2KMnO4+16HCl=2KCl+ 2MnCl2+5Cl2��+8H2O����Ӧ���ɱ����3.36L����ʱ����0.15molCl2��ת�Ƶ���0.3mol����������HCl�����ʵ���Ϊ0.3mol���ʴ�Ϊ��0.3mol��
(2)��Ӧ�������к��������Ȼ��⡢ˮ���������Ա���ʳ��ˮ�����Ȼ������壻����©����Һ��仯�������ƽ��ѹǿ���ʴ�Ϊ����ȥ�����е��Ȼ��⣬ƽ��ѹǿ��
(3)װ��C��������̽��������Na2S��Һ��Ӧ����Ӧ��ʼ�۲쵽C�в�����ɫ������ΪS��������Ӧ�Ļ�ѧ����ʽΪCl2+Na2S==2NaCl+S�����ʴ�Ϊ��Cl2+Na2S==2NaCl+S����
(4)װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ���֤�����Ƿ����Ư���ԣ�Ҫ��֤����������Ư���ԣ�ʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�ѡ����abc�Ģ��ж��Ǹ��������ͨ��ʪ�����ɫ����������֤������Ư���ԣ�����C��I��II��III���η���ʪ�����ɫ��������ˮ�Ȼ���(�轺��P2O5)���������ɫ�������ʴ�Ϊ����ˮ�Ȼ���(�轺��P2O5)���������ɫ������
(5)װ��C�еμӹ��������ᣬ������ð�����ٵμ�BaCl2��Һ��������ɫ������˵����������������ӣ������ɵĺ���Ԫ�ص�����Ϊ�����ƣ���˹�����������Na2S��Һ��Ӧ�����ӷ���ʽΪS2-+4Cl2+4H2O=SO42-+8Cl-+8H+���ʴ�Ϊ��Na2SO4��S2-+4Cl2+4H2O=SO42-+8Cl-+8H+��
(6) ���������(Na2S2O3)��Һ�ڹ�ҵ�Ͽ������ȼ���˵����������ƾ��л�ԭ�ԣ��������ն������������Ӧ�����ӷ���ʽΪS2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+���ʴ�Ϊ��S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+��
(7)������������Һ�в���������H+����������Na2S2O3������ӦS2O32-+2H+=S��+SO2��+H2O�������ж����壬��Ⱦ���������װ��E�е��Լ����������ʴ�Ϊ����Ϊ������������Һ�в���������H+����������Na2S2O3������ӦS2O32-+2H+=S��+SO2��+H2O�������ж����壬��Ⱦ������

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�

