题目内容
11.下列说法不正确的是( )| A. | 234U,235U,238U是不同的核素,互称同位素 | |
| B. | 陶瓷,玻璃,水晶,红宝石都属于硅酸盐 | |
| C. | Na与熔融的KCl反应能制取K,但不能证明Na的金属性比K强 | |
| D. | 在400℃,800个大气压下,钠能与二氧化碳生成钻石和石墨,反应过程中CO2被还原 |
分析 A.同位素是指质子数相同,中子数不同的同种元素的不同核素;
B.红宝石的主要成分是氧化铝,水晶的主要成分是二氧化硅;
C.Na的金属性比K弱,Na的沸点高于K;
D.化合价降低,是氧化剂,被还原;
解答 解:A.234U,235U,238U的质子数相同,中子数不同的核素,互称同位素,故A正确;
B.红宝石的主要成分是氧化铝,水晶的主要成分是二氧化硅,不属于硅酸盐产品,故B错误;
C.Na的金属性比K弱,在850℃时使K蒸汽分离出,而钠为液体,可用钠制取钾,利用的是高沸点金属制备低沸点金属,故C正确;
D.二氧化碳生成钻石和石墨,CO2中化合价降低,是氧化剂,被还原,故D正确;
故选B.
点评 本题考查了同位素、物质的性质,氧化还原反应,注意基础知识的积累,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
6.下列说法正确的是( )
| A. | 油脂、糖类和蛋白质是三大营养物质,都能发生水解;被称作“人体核武器”的维生素B2含有肽键结构等,也能发生水解 | |
| B. | 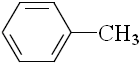 、 、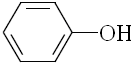 和 和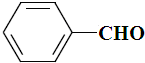 ,仅第一种能使KMnO4酸性溶液褪色 ,仅第一种能使KMnO4酸性溶液褪色 | |
| C. | 氨基酸主要以内盐形式存在,调节溶液的pH不可改变它在水中的溶解度 | |
| D. | 体检报告单中的“甘油三酯”是甘油的衍生物,其中甘油结构简式是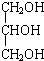 |
16. 利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )
利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )
 利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )
利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )| A. | a为负极,电极反应式为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| B. | 反应过程中产生的质子透过阳离子交换膜扩散到好氧区 | |
| C. | 装置中的离子交换膜是阳离子交换膜 | |
| D. | 该装置把电能转化为生物质能 |
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 3.9gNa2O2晶体中阴阳离子总数为0.15NA | |
| B. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
1. 我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题:(用A、B、C、D、E,所对应的元素符号作答)
(1)B、C、D第一电离能由大到小为N>O>C.
(2)E的二价离子的电子排布式为1s22s22p63s23p63d9.
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为sp2;1molA2B2D4分子中含有σ键数目为7×6.02×1023.
(4)与化合物BD互为等电子体的阴离子化学式为CN-等;
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
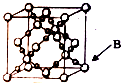
(6)BD2在高温高压下所形成晶体的晶胞如图所示,一个该晶胞中含16个D原子.
 我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层P轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)B、C、D第一电离能由大到小为N>O>C.
(2)E的二价离子的电子排布式为1s22s22p63s23p63d9.
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为sp2;1molA2B2D4分子中含有σ键数目为7×6.02×1023.
(4)与化合物BD互为等电子体的阴离子化学式为CN-等;
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(6)BD2在高温高压下所形成晶体的晶胞如图所示,一个该晶胞中含16个D原子.
 ,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
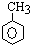 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$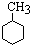
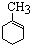 _
_
 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.