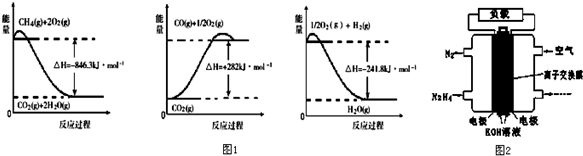
题目内容
5.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 1 mol•L-1NaClO溶液中含有的ClO-数目为NA | |
| B. | 常温常压下,11.2 L Cl2含氯原子数为NA | |
| C. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
分析 A.溶液体积未知;
B.常温常用下,Vm≠22.4L/mol,无法计算氯气的物质的量;
C.合成氨为可逆反应;
D.S2、S4、S8都是与S原子构成的,6.4g混合物中含有6.4gS原子,含有0.2mol硫原子;
解答 解:A.溶液体积未知,无法计算次氯酸根离子数目,故A错误;
B.常温常用下,Vm≠22.4L/mol,无法计算氯气的物质的量和含氯原子数,故B错误;
C.合成氨为可逆反应,一定条件下,将1 mol N2和3 mol H2混合,不能完全反应生成2mol氨气,转移的电子数小于6NA,故C错误;
D.6.4gS2、S4、S8的混合物中含有6.4gS原子,含有0.2mol硫原子,所含S原子数为0.2NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意气体摩尔体积适用对象和条件,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
15.已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1.12×10-12,下列叙述正确的是( )
| A. | 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| B. | 向2.0×10-4 mol/L的K2CrO4溶液中加入等体积的2.0×10-4mol/AgNO3溶液后,则有Ag2CrO4沉淀生成 | |
| C. | 将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中的Cl的物质的量浓度最大 | |
| D. | 将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/L的K2CrO4的混合溶液中,则先产生AgCl沉淀. |
16. 利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )
利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )
 利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )
利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )| A. | a为负极,电极反应式为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| B. | 反应过程中产生的质子透过阳离子交换膜扩散到好氧区 | |
| C. | 装置中的离子交换膜是阳离子交换膜 | |
| D. | 该装置把电能转化为生物质能 |
10.短周期元素X、Y、Z、W、M的原子序数依次增大,X、Z同主族,Z、W、M同周期,其中X和Y能形成两种物质,且常温下均为液体.W的氧化物既能溶于强碱溶液,又能溶于X、M形成的水溶液.已知W与M形成的物质在178℃时升华.下列说法不正确的是( )
| A. | Z、W、M的原子半径由大到小的顺序为Z>W>M | |
| B. | M分别与Z、W所形成的物质的晶体类型相同 | |
| C. | X2Y2易溶于X2Y中,是由于X2Y2与X2Y能形成分子间氢键 | |
| D. | 将Z2Y在空气中加热可得到Z2Y2 |
17.下列溶液中粒子的物质的量浓度关系一定正确的是( )
| A. | 常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(H2A) | |
| B. | Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+) | |
| C. | 向NaOH溶液中滴入CH3COOH溶液后溶液显碱性:c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1的HF溶液与KF溶液等体积混合:c(F-)+c(HF)=0.2mol•L-1 |
14.用下列装置进行相应实验,能达到实验目的是( )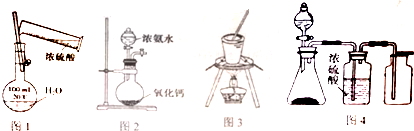

| A. | 用图1所示配制一定浓度的稀硫酸 | B. | 用图2装置实验室制取氨气 | ||
| C. | 用图3装置蒸发饱和食盐水 | D. | 用图4装置制取、收集乙炔气体 |
15. 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| C. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(CI{O}^{-})}$减小 |