题目内容
10.NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1.0mol/L的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 12g金刚石中含有碳酸键的个数为2NA | |
| C. | 25℃时1.0LpH=13的NaOH溶液中含有H+的数目为0.1NA | |
| D. | 1mol的甲基与1mol的铵银离子所含电子数均为10NA. |
分析 A.偏铝酸钠溶液中,偏铝酸钠和水都含有氧原子;
B.根据1mol金刚石含有2molC-C键进行判断;
C.pH=13的NaOH溶液,氢离子浓度为10-13mol/L;
D.1个甲基含有9个电子,一个氨根离子含有10个电子.
解答 解:A.偏铝酸钠溶液中,偏铝酸钠和水都含有氧原子,1.0mol/L的NaAlO2水溶液中含有的氧原子数远远大于2NA,故A错误;
B.金刚石中的碳都是与相邻的4个碳组成的四个共价键,但是每个共价键是两个C原子共用的,所以1mol碳原子就有2mol的C-C键;12g金刚石中含有1molC原子,含有C-C键的个数为2NA,故B正确;
C.25℃时1.0LpH=13的NaOH溶液中含有H+的数目,10-13mol/L×1L×NA,=10-13NA,故C错误;
D.1mol的甲基所含电子数为9NA与,1mol的铵银离子所含电子数为10NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意金刚石结构,题目难度不大.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 硫酸亚铁铵晶体要用冷水洗涤,而阿斯匹林过滤后则须用无水酒精洗涤 | |
| B. | 食醋总酸含量的测定实验中,若滴定终点没有控制好,即NaOH溶液滴加过量,则必须重做实验 | |
| C. | 火柴头中的氯元素检验的实验中,将火柴头(未燃烧)浸于水中,片刻后取少量溶液,加AgNO3溶液、稀硝酸,若出现白色沉淀,证明有氯元素 | |
| D. | 毒物误入口内,可将5~10mL稀硫酸铜溶液加入一杯温水中内服,人工促使呕吐出毒物后送医院 |
5.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值产品是目前的研究目标.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分物质的量如表:
①此温度下该反应的平衡常数K=64.
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ.mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3 kJ•mol-1.
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂.可以将CO2和CH4直接转化为成乙酸.
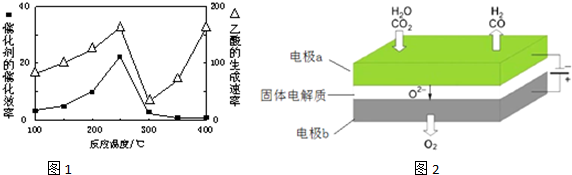
①在不同温度下催化剂的催化效果与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是缩小体积增大压强或增大CO2的浓度.
(3)①Li2O、Na2O、MgO均能吸收CO2.如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4用于吸收、释放CO2.原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐;平衡后加热至700℃,反应逆向进行放出CO2,Li4SiO4再生,写出CO2和Li4SiO4反应的化学方程式CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{\;}$Li2CO3+Li2SiO3.
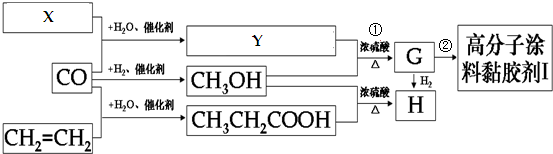
(4)反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO2+H2+O2利用反应A可将释放的CO2转化为具有工业利用价值的产品.高温电解技术能高效实现反应A,工作原理示意图如图2.CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分物质的量如表:
| 物质 | CH4 | CO2 | CO | H2 |
| 物质的量mol | 2 | 2 | 8 | 8 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ.mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3 kJ•mol-1.
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂.可以将CO2和CH4直接转化为成乙酸.
①在不同温度下催化剂的催化效果与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是缩小体积增大压强或增大CO2的浓度.
(3)①Li2O、Na2O、MgO均能吸收CO2.如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4用于吸收、释放CO2.原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐;平衡后加热至700℃,反应逆向进行放出CO2,Li4SiO4再生,写出CO2和Li4SiO4反应的化学方程式CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{\;}$Li2CO3+Li2SiO3.

(4)反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO2+H2+O2利用反应A可将释放的CO2转化为具有工业利用价值的产品.高温电解技术能高效实现反应A,工作原理示意图如图2.CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
15.已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1.12×10-12,下列叙述正确的是( )
| A. | 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| B. | 向2.0×10-4 mol/L的K2CrO4溶液中加入等体积的2.0×10-4mol/AgNO3溶液后,则有Ag2CrO4沉淀生成 | |
| C. | 将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中的Cl的物质的量浓度最大 | |
| D. | 将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/L的K2CrO4的混合溶液中,则先产生AgCl沉淀. |
 ,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
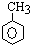 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$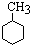
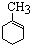 _
_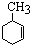
 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.