题目内容
【题目】某地环保部门将收集到的一定量酸雨试样分成甲、乙、丙、丁四份,进行如图所示的实验探究。
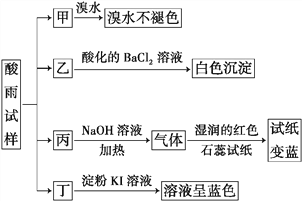
已知酸雨试样中可能含有下表所示的某些离子:
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO32-、Y、NO3- |
请回答下列问题:
(1)X是________________________,Y是__________________________。
(2)可能存在的阴离子是______________________,能证明该阴离子是否存在的简单实验操作为_______________________________________________________________________________________________________________________。
(3)写出丁试样中滴加淀粉KI溶液所发生反应的离子方程式: ______________________________________。
【答案】 NH4+ SO42- Cl- 取少量酸雨试样,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加AgNO3溶液,若有白色沉淀产生,则存在Cl-,若无白色沉淀产生,则不存在Cl- 6I-+2NO3-+8H+3I2+2NO↑+4H2O
【解析】酸雨试样分成甲、乙、丙、丁四份,甲中加入溴水不褪色,说明酸雨中不含还原性的SO32-,乙中加入酸化的氯化钡生成白色沉淀说明含有SO42-,则阴离子Y为SO42-,丙中加入氢氧化钠溶液并加热,反应生成的气体使湿润的红色石蕊试纸变蓝色,该气体是氨气,说明原溶液中含有NH4+,则阳离子X为NH4+,丁中加入淀粉碘化钾溶液后,溶液呈蓝色,说明溶液中含有氧化性离子,能将碘离子氧化为单质碘,则含有NO3-,上述步骤均不能检验酸雨中是否含有Cl-。
(1). 由上述分析可知,X是NH4+,Y是SO42-,故答案为:NH4+;SO42-;
(2). 表中不能确定是否存在的阴离子是Cl-,能证明Cl-是否存在的简单实验操作为:取少量酸雨试样,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加AgNO3溶液,若有白色沉淀产生,则存在Cl-,若无白色沉淀生成,则不存在Cl-,故答案为:Cl-;取少量酸雨试样,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加AgNO3溶液,若有白色沉淀产生,则存在Cl-,若无白色沉淀产生,则不存在Cl-;
(3). 在酸性条件下,NO3-将I-氧化成单质I2,自身被还原成NO,根据得失电子守恒和原子守恒,该反应的离子方程式为:6I-+2NO3-+8H+=3I2+2NO↑+4H2O,故答案为:6I-+2NO3-+8H+=3I2+2NO↑+4H2O。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
