��Ŀ����
�ظ�����ǹ�ҵ������ʵ���ҵ���Ҫ����������ҵ�ϳ��ø�������Ҫ�ɷ�ΪFeO��Cr2O3������ΪSiO2��Al2O3��Ϊԭ�ϲ�����ʵ����ģ�ҵ���ø�������K2Cr2O7����Ҫ��������ͼ���漰����Ҫ��Ӧ��6FeO��Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O��
12Na2CrO4+3Fe2O3+7KCl+12H2O��

��1�����ǰ������������������
��2������۵���pH����˵õ��������� ��
��3���������У��ữʱ��CrO2- 4ת��ΪCr2O2- 7��д��ƽ��ת�������ӷ���ʽ
��
��4���ü�Ҫ������˵�������ݼ���KCl��ԭ�� ��
��5����ȡ�ظ��������2.500g���250mL��Һ��ȡ��25mL�����ƿ�У�����10mL2mol/ LH2SO4�������⻯�أ����Ļ�ԭ����ΪCr3+)�����ڰ���5min��Ȼ�����100mLˮ������3mL����ָʾ������0.1200mol/LNa2S2O3����Һ�ζ���I2+2S2O2- 3��2I- +S4O2- 6��
���жϴﵽ�ζ��յ�������� ��
����ʵ���й���ȥNa2S2O3����Һ40.00mL�������ò�Ʒ���ظ���صĴ���Ϊ���������������������ʲ��μӷ�Ӧ�� ������2λ��Ч���֣���
 12Na2CrO4+3Fe2O3+7KCl+12H2O��
12Na2CrO4+3Fe2O3+7KCl+12H2O��
��1�����ǰ������������������
��2������۵���pH����˵õ��������� ��
��3���������У��ữʱ��CrO2- 4ת��ΪCr2O2- 7��д��ƽ��ת�������ӷ���ʽ
��
��4���ü�Ҫ������˵�������ݼ���KCl��ԭ�� ��
��5����ȡ�ظ��������2.500g���250mL��Һ��ȡ��25mL�����ƿ�У�����10mL2mol/ LH2SO4�������⻯�أ����Ļ�ԭ����ΪCr3+)�����ڰ���5min��Ȼ�����100mLˮ������3mL����ָʾ������0.1200mol/LNa2S2O3����Һ�ζ���I2+2S2O2- 3��2I- +S4O2- 6��
���жϴﵽ�ζ��յ�������� ��
����ʵ���й���ȥNa2S2O3����Һ40.00mL�������ò�Ʒ���ظ���صĴ���Ϊ���������������������ʲ��μӷ�Ӧ�� ������2λ��Ч���֣���
(14��)
��1������Ӵ����������Ӧ���ʣ�2�֣�
��2��Al(OH)3��H2SiO3��2�֣�
��3��2 CrO2- 4+2H+ Cr2O2- 7+H2O��2�֣�
Cr2O2- 7+H2O��2�֣�
��4���¶ȶ��Ȼ��Ƶ��ܽ��Ӱ��С�������ظ���ص��ܽ��Ӱ��ϴ����ø��ֽⷴӦ���ɵõ��ظ���أ�2�֣�
��5���ٵ��μ����һ�������������Һ����Һ��ɫ��ɫ��2�֣���94.08 %��2�֣�
��1������Ӵ����������Ӧ���ʣ�2�֣�
��2��Al(OH)3��H2SiO3��2�֣�
��3��2 CrO2- 4+2H+
 Cr2O2- 7+H2O��2�֣�
Cr2O2- 7+H2O��2�֣���4���¶ȶ��Ȼ��Ƶ��ܽ��Ӱ��С�������ظ���ص��ܽ��Ӱ��ϴ����ø��ֽⷴӦ���ɵõ��ظ���أ�2�֣�
��5���ٵ��μ����һ�������������Һ����Һ��ɫ��ɫ��2�֣���94.08 %��2�֣�
���������
��1������������������������Ӵ����������Ӧ���ʣ�
��2�����ݹ�������ͼ�п��Կ����ڷ�Ӧ����SiO2��Al2O3��NaOH��Ӧ�ֱ�ת��ΪNa2SiO3��NaAlO2, ����۵���pH����˵õ���������Al(OH)3��H2SiO3��
��3���ữʱ��CrO2- 4ת��ΪCr2O2- 7ƽ��ת�������ӷ���ʽΪ2CrO2- 4+2H+
 Cr2O2- 7+H2O��
Cr2O2- 7+H2O����4�����������Ϣ�¶ȶ��Ȼ��Ƶ��ܽ��Ӱ��С�������ظ���ص��ܽ��Ӱ��ϴ����ø��ֽⷴӦ�����½ᾧʱ�õ������ظ���ء�
��5�����ⵥ�ʴ��ڿ��õ��ۣ�ֱ����ɫ��ȥ�������ɵù�ϵʽ��Cr2O2- 7~3I2~6S2O2- 3��n(S2O2- 3)=0.04L��0.12mol/L����25ml��1/6n(S2O2- 3)= n(Cr2O2- 7)=0.0008mol����250ml�к��е�m(K2Cr2O7)=0.0008mol��10��294g/mol=2.352g����֪��������Ϊ2.352g/2.500g��100%=94.08%��

��ϰ��ϵ�д�
 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
�����Ŀ
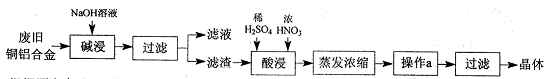


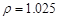 g/cm3 )����ȡ��36.5% (
g/cm3 )����ȡ��36.5% (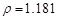 g/cm3 )������ mL
g/cm3 )������ mL
 ����
����
