题目内容
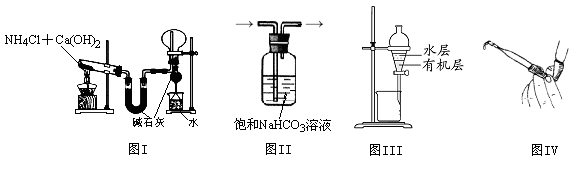
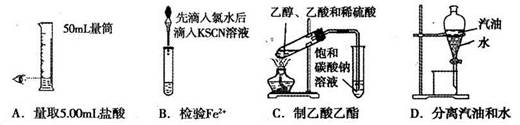
关于下列各装置图的叙述中,正确的是


AB
试题分析:硫酸亚铁溶液与氢氧化钠溶液易反应,生成氢氧化亚铁沉淀和硫酸钠,煤油的密度比水小,浮在水面可以隔绝空气,防止生成的氢氧化亚铁悬浊液被氧气氧化,胶头滴管伸入水层滴加氢氧化钠溶液也是防止氧化的措施,故A正确;热稳定性:NaHCO3<Na2CO3,根据控制变量设计实验方案的原则,碳酸氢钠应置于远离火焰的内管,碳酸钠应置于靠近火焰的外管,较低温度加热能分解产生使澄清石灰水变浑浊的气体,较高温度加热不能产生使澄清石灰水变浑浊的气体,则相同温度加热时碳酸氢钠一定比碳酸钠容易分解,反之则不能得到合理的结论,故B正确;氯化铵固体不稳定,受热易分解产生氨气和氯化氢气体,而氨气和氯化氢气体遇冷又能反应,重新生成氯化铵固体,因此不能用该法制取氨气,通常实验室用氯化铵固体和熟石灰固体混合加热制取氨气,故C错误;分离沸点不同且互溶的液体混合物时,温度计应测定蒸气的温度,而不是插入液面下测定液体的温度,故D错误。

练习册系列答案
相关题目
 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。

 [Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。
[Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。