题目内容
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如下:

已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过______次过滤操作。
(2)“氧化”发生反应的离子方程式为__________;若用HNO3代替H2O2不足之处是_____。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________mol/L。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=________。
(4)“沉锂" 时的温度应选(填标号)______为宜,并用___洗涤(填“热水" 或“冷水")。
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为________。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为________
【答案】5 H2O2+2Fe2++2H+=2Fe3++2H2O 产生氮的氧化物,污染空气 2.6×10-6 8 a 热水 FePO4+e-+Li+=LiFePO4 2FePO4+ Li2CO3+ H2C2O4![]() 2LiFePO4+H2O+3CO2↑
2LiFePO4+H2O+3CO2↑
【解析】
由已知废旧电池正极片为磷酸亚铁锂、炭黑和铝箔等,加氢氧化钠溶液后,铝箔溶解,通过过滤除去含铝的溶液,滤渣加入硫酸,溶解磷酸亚铁锂,炭黑不溶,再过滤除去炭黑,滤液中加入H2O2,氧化Fe2+生成Fe3+,加入NaOH和NH3·H2O调节pH,使Fe3+变成Fe(OH)3沉淀。过滤后除去沉淀,滤液中加入碳酸钠,碳酸锂在水中的溶解度很小,把易容的硫酸锂转化为微溶的碳酸锂即可。
(1)根据上述分析可知上述流程中至少需要经过5次过滤操作。答案:5。
(2)H2O2具有强氧化性,可以把Fe2+氧化生成Fe3+,此反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O;若用HNO3代替H2O2容易产生具有污染性的氮的氧化物气体。答案:H2O2+ 2Fe2++2H+=2Fe3++2H2O;产生氮的氧化物,污染空气;
(3)①pH=3.0时,c(H+)=1.0×10-3 mol/L,c(OH-)=1.0×10-11mol/L,Ksp[Fe(OH)3]=2.6×10-39,所以c(Fe3+)=2.6×10-39/(1.0×10-11)3 mol/L =2.6×10-6 mol/L;答案:2.6×10-6。
②由图表数据分析可知pH=8时,铁元素的沉淀率较高,锂元素损失量较小,故应调节pH=8沉淀最佳;答案:8;
(4)因为碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。90℃ 反应速率较快,而碳酸锂溶解度很小,所以“沉锂"时的温度应选90℃为宜,并用热水洗涤。答案:a、热水。
(5)磷酸亚铁锂电池在工作时,正极发生还原反应,所以是FePO4得电子生成,该电池放电时正极的电极反应式为FePO4+e-+Li+=LiFePO4;答案:FePO4+e-+Li+=LiFePO4。
(6)用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备LiFePO4,根据元素守恒即可得到化学方程式为:2FePO4+ Li2CO3+ H2C2O4![]() 2LiFePO4+H2O+3CO2↑;答案:2FePO4+ Li2CO3+ H2C2O4
2LiFePO4+H2O+3CO2↑;答案:2FePO4+ Li2CO3+ H2C2O4![]() 2LiFePO4+H2O+3CO2↑。
2LiFePO4+H2O+3CO2↑。

【题目】钒(V)为过渡元素,可形成多价态化合物,全钒液流电池是一种新型的绿色环保储能系统,工作原理如下图:

已知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是_______
(2)当完成储能时,正极溶液的颜色是 __________
(3)质子交换膜的作用是_________
(4)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液酸碱性不同钒元素的存在形式不同:
钒的化合价 | 酸性 | 碱性 |
+4价 | VO2+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①滤液中钒元素的主要存在形式为_______
②滤渣在空气中由灰白色转变为红褐色,用化学用语表示加入NaOH后生成沉淀的反应过程_______________、____________。
③萃取、反萃取可实现钒的分离和富集,过程可简单表示为(HA为有机萃取剂):
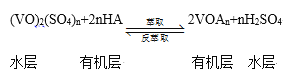
萃取时必须加入适量碱,其原因是 __________
④纯钒可由熔盐电解法精炼,粗钒(含杂质)作____极。






