题目内容
【题目】雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。
(1)用SO2气体可以消除汽车尾气中NO2, 已知NO2(g)+SO2(g)![]() SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为________。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是_____(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式 ____________________。
(4)已知NH3·H2O的Kb=2.0 ×10-5
①求0.10 mol/L的 NH3·H2O的c(OH-)=______________mol/L
②若向其中加入固体NH4Cl,使c(NH4+)的浓度达到0.20 mol/L,则c(OH-)=______mol/L。
【答案】 2.67(8/3) 40% c d 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1 1.4×10-3 1 ×10-5
N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1 1.4×10-3 1 ×10-5
【解析】试题分析:(1)利用“三段式”计算NO2(g)+SO2(g)![]() SO3(g)+NO(g) 的平衡常数;(2)①有害气体NO的转化率=NO的变化量÷NO的初始量×100%;②根据影响化学平衡的因素进行判断;(3)根据盖斯定律计算NO2与CO的反应热;(4)根据Kb=
SO3(g)+NO(g) 的平衡常数;(2)①有害气体NO的转化率=NO的变化量÷NO的初始量×100%;②根据影响化学平衡的因素进行判断;(3)根据盖斯定律计算NO2与CO的反应热;(4)根据Kb=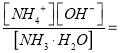 2.0 ×10-5计算c(OH-);
2.0 ×10-5计算c(OH-);
解析:(1)将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中,设开始时NO2的浓度为amol/L,则SO2的浓度为2amol/L;NO2浓度变化为xmol/L;
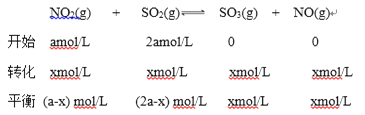
(a-x) mol/L:(2a-x) mol/L=1:6;
x=0.8a
![]() ;
;
(2)①将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,NO、CO的浓度分别是1 mol/L、1.2mol/L,根据图示,平衡时CO浓度的变化量为0.4 mol/L,则有害气体NO的浓度变化量是0.4 mol/L,NO的转化率是![]() ;
;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,但平衡时CO浓度大于第一次平衡浓度,故a错误; b.增加CO的量,平衡向正反应方向移动,但CO的浓度增大,故b错误; c.降低温度,平衡向正反应方向移动,则CO的浓度减小,故c正确;d.扩大容器体积,压强减小,平衡向逆反应方向移动,但平衡时CO浓度小于第一次平衡浓度,故d正确;
(3)CO的燃烧热△H=-c kJ·mol-1,即①CO(g)+![]() O2(g)= CO2(g)△H=-c kJ·mol-1 。
O2(g)= CO2(g)△H=-c kJ·mol-1 。
② 2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;
③ 2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1;
N2(g)+2CO2(g) △H=-a kJ·mol-1;
根据盖斯定律,③-②+①×2得 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1;
N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1;
(4)①根据Kb=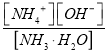
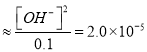 ,c(OH-)=1.4×10-3;
,c(OH-)=1.4×10-3;
②若向其中加入固体NH4Cl,氯化铵抑制氨水电离, ![]() 接近0.1mol/L,根据
接近0.1mol/L,根据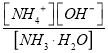 =2.0 ×10-5,
=2.0 ×10-5, ![]() 2.0 ×10-5, c(OH-)=1×10-5。
2.0 ×10-5, c(OH-)=1×10-5。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
