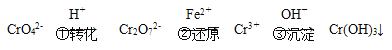题目内容
【题目】硝酸工业生产中常用纯碱溶液吸收排出的氮氧化物废气,废气中只含有NO、NO2两种气体。将一定量废气通入到足量的Na2CO3溶液中被完全吸收,溶液中生成的NO3-、NO2-两种离子的物质的量与废气中NO2的物质的量分数x![]() 变化关系可用图所示。已知溶液中可发生以下两个反应:
变化关系可用图所示。已知溶液中可发生以下两个反应:
①NO+NO2+Na2CO3=2NaNO2+CO2;
②2NO2+Na2CO3=NaNO2+NaNO3+CO2

下列说法正确的是
A.图中线段a表示NO3-离子
B.随x值增大,溶液中n(NO3-)+n(NO2-)增大
C.x=0.6时,反应中可收集到标准状况下CO2 44.8 L
D.若测得所得溶液中n(NO3-)为0.5 mol,则x值为0.75
【答案】D
【解析】
由方程式和图象可知,NO单独不能被吸收:
①当NO和NO2混合气体被NaOH溶液恰好完全吸收,满足n(NO2):n(NO)=1,即x=0.5,此时只生成NO2-,n(NO3-)=0,n(NO2-)=2mol,所以a曲线表示NO2-离子、b曲线表示NO3-离子;
②当气体只有NO2时,即x=1,发生反应2NO2+Na2CO3═NaNO2+NaNO3+CO2,此时生成n(NO3-)=n(NO2-)=1mol;
③由x=0.5和x=1可知,一定量废气中n(NO2)≥n(NO),并且n(NO2)+n(NO)=2mol,生成n(NO3-)+n(NO2-)=2mol;
④反应NO+NO2+Na2CO3═2NaNO2+CO2和2NO2+Na2CO3═NaNO2+NaNO3+CO2均有n(N)=2n(C),即n(NO2)+n(NO)=2n(CO2)=2mol,所以n(CO2)=1mol;
综上可知:2mol废气通入到足量的Na2CO3溶液中被完全吸收,即n(NO2)≥n(NO),生成n(NO3-)+n(NO2-)=2mol;n(CO2)=1mol;a曲线表示NO2-离子、b曲线表示NO3-离子。
A.当x=0.5时,只发生反应NO+NO2+Na2CO3═2NaNO2+CO2,n(NO3)=0,n(NO2)=2mol,所以a曲线表示NO2离子、b曲线表示NO3离子,故A错误;
B.当x=0.5时,只生成NO2,n(NO2)=2mol;当x=1只发生反应2NO2+Na2CO3═NaNO2+NaNO3+CO2,此时生成n(NO3)=n(NO2)=1mol,根据N原子守恒可知混合气体的总的物质的量为2mol,即溶液中n(NO3)+n(NO2)不变、始终等于2mol,故B错误;
C.由于废气中n(NO2)n(NO),并且n(NO2)+n(NO)=2mol,根据反应①②可知n(NO2)+n(NO)=2n(CO2)=2mol,即n(CO2)=1mol,标准状况下体积为22.4L,故C错误;
D.设n(NO2)=a,n(NO)=b,则a+b=2mol,发生反应①余下NO2的物质的量为(ab)mol,发生反应②生成n(NO3)=0.5(ab)=0.5mol,即ab=1mol,联立方程组解得a=1.5mol,b=0.5mol,废气中NO2的物质的量分数x=![]() ×100%=75%,故D正确;
×100%=75%,故D正确;
答案选D。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】利用CO2重整CH4制合成气的反应为CO2(g)+CH4(g)![]() 2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
容器 | 温度/℃ | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | |||
n(CO2) | n(CH4) | n(CO) | n(H2) | n(H2) | ||
Ⅰ | T1 | 0 | 0.8 | 0.8 | 0.8 | 0.6 |
Ⅱ | T1 | 1.2 | 1.2 | 1.2 | 1.2 | / |
Ⅲ | T2 | 1.0 | 2.0 | 0 | 0 | 1.0 |
Ⅳ | T2 | 0.5 | 1.0 | 0 | 0 | / |
下列说法正确的是( )
A. T1>T2
B. 容器Ⅱ起始时的反应速率:v(正)>v(逆)
C. 容器Ⅰ、Ⅲ达到平衡时,容器内气体总压强之比:p(Ⅰ)∶p(Ⅲ) =11∶20
D. 容器Ⅲ中CO2的平衡转化率比容器Ⅳ中的小
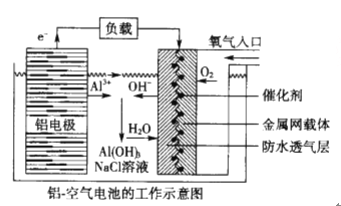
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如下:

已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过______次过滤操作。
(2)“氧化”发生反应的离子方程式为__________;若用HNO3代替H2O2不足之处是_____。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________mol/L。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=________。
(4)“沉锂" 时的温度应选(填标号)______为宜,并用___洗涤(填“热水" 或“冷水")。
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为________。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为________