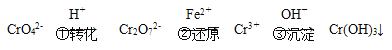题目内容
【题目】图中,固体A是铁锈的主要成分。
![]()
请回答:
(1)固体C的化学式是___,上述框图中体现了SO2的___(填“氧化性”、“还原性”或“漂白性”)。
(2)写出A→B的化学方程式___。
(3)写出D→E的离子方程式___。
(4)若通入的SO2是足量的,请你设计实验方案检验“溶液D”中的金属阳离子___。
【答案】FeCl3 还原性 Fe2O3+3CO![]() 2Fe+3CO2 Ba2++SO42-=BaSO4↓ 取少量溶液D于试管中,滴加KSCN溶液,无明显现象,再滴加适量氯水(或双氧水),溶液变成血红色,则含有Fe2+
2Fe+3CO2 Ba2++SO42-=BaSO4↓ 取少量溶液D于试管中,滴加KSCN溶液,无明显现象,再滴加适量氯水(或双氧水),溶液变成血红色,则含有Fe2+
【解析】
固体A是铁锈的主要成分,则A为Fe2O3,结合图中转化可知,A与CO反应生成B为Fe,B与氯气反应生成C为FeCl3,C与二氧化硫发生氧化还原反应,溶液D中Fe2+、SO42-等,溶液D与氯化钡反应生成白色沉淀E为BaSO4。
(1)由上述分析可知,固体C的化学式是:FeCl3,上述框图中SO2失去电子转化为硫酸根离子,作还原剂;
(2)A→B的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(3)D→E的离子方程式为:Ba2++SO42=BaSO4↓;
(4)若通入的SO2是足量的,溶液D中金属阳离子为Fe2+,检验该阳离子的方法为:取少量溶液D于试管中,滴加KSCN溶液,无明显现象,再滴加适量氯水(或双氧水),溶液变成血红色,则含有Fe2+。

【题目】NF3是微电子工业中常用的一种等离子蚀刻气体,具有较强的氧化性,工业生产NF3常用的方法有气一液反应法、气一固反应法和电解法等。
(1)气一液反应法中发生的主反应和副反应包括:
3F2(g)+NH3(l)=NF3(g)+3HF(l) △H1
3F2(g)+NH4HF2(l)=NF3(g)+5HF(l) △H2
4F2(g)+2NH3(l)=N2F2(g)+6HF(l) △H3
NH3(l)+2HF(l)=NH4HF2(l) △H4
△H1=_____。部分键能数据如下表所示,△H3=_____kJ/mol。
化学键 | N-N | N=N | N | H-F | F-F | N-H | N-F |
键能(kJ/mol) | 159 | 456 | 946 | 565 | 153 | 389 | 272 |
(2)气一固反应法主要包括两步反应:
(NH4)3AlF6(s)+6F2(g)![]() 2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
NH4AlF4(s)+3F2(g)![]() NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
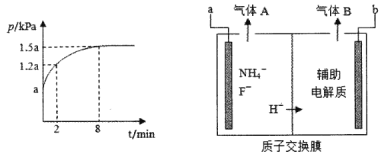
反应I的平衡常数K1和反应II的平衡常数的关系是___。若在恒温、恒容的密闭容器中模拟气一固反应法(固体足量),起始时F2的浓度为5mol/L,反应过程中容器中压强一随时间变化曲线如图所示,则前2min的平均反应速率v(NF3)=___mol/(Lmin),该温度下K2=___。
(3)电解法是通过电解含氟的熔融盐生产NF3,其原理如图所示。a需要接电源的____(填“正极”或“负极”),生成气体A的电极反应是____。
(4)用NF3对多晶硅电子元件进行蚀刻时不会在电子元件表面形成任何残留物,其原因是_____。(用化学用语解释)
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如下:

已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过______次过滤操作。
(2)“氧化”发生反应的离子方程式为__________;若用HNO3代替H2O2不足之处是_____。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________mol/L。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=________。
(4)“沉锂" 时的温度应选(填标号)______为宜,并用___洗涤(填“热水" 或“冷水")。
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为________。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为________