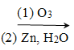ĚâÄżÄÚČÝ
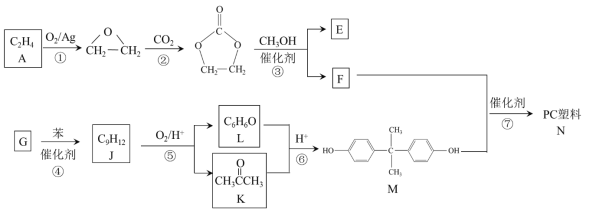
ˇľĚâÄżˇż·°Ł¨VŁ©ÎŞąý¶ÉÔŞËŘŁ¬żÉĐγɶŕĽŰ̬»ŻşĎÎȫ·°ŇşÁ÷µçłŘĘÇŇ»ÖÖĐÂĐ͵ÄÂĚÉ«»·±Ł´˘ÄÜϵͳŁ¬ą¤×÷ÔŔíČçĎÂÍĽŁş

ŇŃÖŞŁş
Ŕë×ÓÖÖŔŕ | VO2+ | VO2+ | V3+ | V2+ |
ŃŐÉ« | »ĆÉ« | Ŕ¶É« | ÂĚÉ« | ×ĎÉ« |
Ł¨1Ł©Č«·°ŇşÁ÷µçłŘ·ĹµçʱV2+·˘ÉúŃő»Ż·´Ó¦Ł¬¸ĂµçłŘ·Ĺµçʱ×Ü·´Ó¦Ę˝ĘÇ_______
Ł¨2Ł©µ±ÍęłÉ´˘ÄÜʱŁ¬ŐýĽ«ČÜŇşµÄŃŐÉ«ĘÇ __________
Ł¨3Ł©ÖĘ×Ó˝»»»Ä¤µÄ×÷ÓĂĘÇ_________
Ł¨4Ł©ş¬·°·ĎË®»áÔěłÉË®ĚĺÎŰČľŁ¬¶Ôş¬·°·ĎË®Ł¨łýVO2+Í⣬»ąş¬Fe3+µČŁ©˝řĐĐ×ۺϴ¦ŔíżÉʵĎÖ·°×ĘÔ´µÄ»ŘĘŐŔűÓĂŁ¬Á÷łĚČçĎÂŁş

ŇŃÖŞČÜŇşËáĽîĐÔ˛»Í¬·°ÔŞËصĴćÔÚĐÎĘ˝˛»Í¬Łş
·°µÄ»ŻşĎĽŰ | ËáĐÔ | ĽîĐÔ |
+4ĽŰ | VO2+ | VO(OH)3- |
+5ĽŰ | VO2+ | VO43- |
˘ŮÂËŇşÖĐ·°ÔŞËصÄÖ÷ŇŞ´ćÔÚĐÎʽΪ_______
˘ÚÂËÔüÔÚżŐĆřÖĐÓɻҰ×ɫת±äÎŞşěşÖÉ«Ł¬ÓĂ»ŻŃ§ÓĂÓď±íĘľĽÓČëNaOHşóÉúłÉłÁµíµÄ·´Ó¦ąýłĚ_______________ˇ˘____________ˇŁ
˘ŰÝÍȡˇ˘·´ÝÍȡżÉʵĎÖ·°µÄ·ÖŔëşÍ¸»ĽŻŁ¬ąýłĚżÉĽňµĄ±íʾΪŁ¨HAÎŞÓĐ»úÝÍȡĽÁŁ©Łş
ÝÍȡʱ±ŘĐëĽÓČëĘĘÁżĽîŁ¬ĆäÔŇňĘÇ __________
˘Ü´ż·°żÉÓÉČŰŃεç˝â·¨ľ«Á¶Ł¬´Ö·°Ł¨ş¬ÔÓÖĘŁ©×÷____Ľ«ˇŁ
ˇľ´đ°¸ˇżV2+ +VO2++2H+=V3++VO2++H2O »ĆÉ« ×č¸ôŃő»ŻĽÁÓ뻹ԼÁŁ¬ĘąÇâŔë×ÓͨąýĐγɵçÁ÷ VO(OH)3- Fe2+ + 2OH-=Fe(OH)2ˇý 4Fe(OH)2+2H2O+O2=4Fe(OH)3 ĽÓČëĽîÖĐşÍÁňËᣬ´ŮʹƽşâŐýĎňŇƶŻŁ¬Ěá¸ß·°µÄÝÍȡÂĘ ŃôĽ«
ˇľ˝âÎöˇż
Ł¨1Ł©BĽ«ĘÇV2+ʧµç×Ó·˘ÉúŃő»Ż·´Ó¦ÉúłÉV3+Ł¬AĽ«VO2+µĂµ˝µç×Ó·˘Éú»ąÔ·´Ó¦ÉúłÉVO2+Ł¬¸ůľÝµçĽ«·´Ó¦Ę˝ĘéĐ´×Ü·´Ó¦Ę˝Ł»
Ł¨2Ł©´˘ÄÜÎŞłäµçąýłĚŁ¬ŐýĽ«şÍÍâ˝ÓµçÔ´ŐýĽ«ĎŕÁ¬Ł¬±ľÉí×÷ŃôĽ«·˘ÉúŃő»Ż·´Ó¦Ł¬µçĽ«·´Ó¦·˝łĚʽΪŁşVO2+- e-+H2O= VO2++2H+Ł»
Ł¨3Ł©ÖĘ×Ó˝»»»Ä¤µÄ×÷ÓĂĘÇ×č¸ôŃő»ŻĽÁÓ뻹ԼÁŁ¬ĘąÇâŔë×ÓͨąýĐγɵçÁ÷Ł»
Ł¨4Ł©˘ŮÓÉÁ÷łĚżÉÖŞÂËҺΪĽîĐÔÇŇĽÓČëĚú·ŰşóVO2+±»»ąÔÎŞVO(OH)3-Ł»
˘ÚFe2+ + 2OH-=Fe(OH)2ˇýˇ˘4Fe(OH)2+2H2O+O2=4Fe(OH)3 ˇŁ
˘Ű·ÖÎöĆ˝şâŁ¬![]() Ł¬ĽÓČëĽîÖĐşÍÁňËᣬ´ŮʹƽşâŐýĎňŇƶŻŁ¬Ěá¸ß·°µÄÝÍȡÂĘŁ»
Ł¬ĽÓČëĽîÖĐşÍÁňËᣬ´ŮʹƽşâŐýĎňŇƶŻŁ¬Ěá¸ß·°µÄÝÍȡÂĘŁ»
˘Üµç˝â·¨ľ«Á¶·°Ł¬ÓĂ´Ö·°×÷ŃôĽ«Ł¬·˘ÉúŃő»Ż·´Ó¦ˇŁ
Ł¨1Ł©ŇňÎŞ·ĹµçʱŁ¬ŇŃÖŞBĽ«ĘÇV2+ʧµç×Ó·˘ÉúŃő»Ż·´Ó¦ÉúłÉV3+Ł¬ËůŇÔAĽ«»áµĂµ˝µç×Ó·˘Éú»ąÔ·´Ó¦Ł¬ąĘµçĽ«·´Ó¦·˝łĚʽΪŁşVO2++e-+2H+=VO2++H2OŁ¬ąĘµçłŘ·Ĺµçʱ×Ü·´Ó¦Ę˝ĘÇV2+ +VO2++2H+=V3++VO2++H2OŁ¬
ąĘ´đ°¸ĘÇŁşV2+ +VO2++2H+=V3++VO2++H2OŁ»
Ł¨2Ł©´˘ÄÜÎŞłäµçąýłĚŁ¬ŐýĽ«şÍÍâ˝ÓµçÔ´ŐýĽ«ĎŕÁ¬Ł¬±ľÉí×÷ŃôĽ«·˘ÉúŃő»Ż·´Ó¦Ł¬µçĽ«·´Ó¦·˝łĚʽΪŁşVO2+- e-+H2O= VO2++2H+Ł¬ËůŇÔµ±ÍęłÉ´˘ÄÜʱŁ¬ŐýĽ«ČÜŇşµÄŃŐÉ«ĘÇ»ĆÉ«Ł»
ąĘ´đ°¸ĘÇŁş»ĆÉ«Ł»
Ł¨3Ł©ÓɵçłŘ·Ĺµçʱ×Ü·´Ó¦Ę˝V2++VO2++2H+=V3++VO2++H2OżÉÖŞŁ¬Á˝µçĽ«µÄÎďÖĘ»ěşĎ»á·˘Éú·´Ó¦Ł¬ąĘÖĘ×Ó˝»»»Ä¤µÄ×÷ÓĂĘÇ×č¸ôŃő»ŻĽÁÓ뻹ԼÁŁ¬ĘąÇâŔë×ÓͨąýĐγɵçÁ÷Ł»
ąĘ´đ°¸ĘÇŁş×č¸ôŃő»ŻĽÁÓ뻹ԼÁŁ¬ĘąÇâŔë×ÓͨąýĐγɵçÁ÷Ł»
Ł¨4Ł©˘Ů¸ůľÝ±íÖĐĐĹϢŁ¬ÓÉÁ÷łĚżÉÖŞÂËҺΪĽîĐÔÇŇĽÓČëĚú·ŰşóVO2+±»»ąÔÎŞVO(OH)3-Ł¬ËůŇÔ·°ÔŞËصÄÖ÷ŇŞ´ćÔÚĐÎʽΪVO(OH)3-Ł¬
ąĘ´đ°¸ĘÇŁşVO(OH)3-Ł»
˘ÚĽÓČëÇâŃő»ŻÄĆÖ®şóŁ¬ÓɻҰ×ɫת±äÎŞşěşÖÉ«Ł¬ŐâĘÇŃÇĚúŔë×Óת»ŻÎŞĚúŔë×ÓŁ¬·´Ó¦ąýłĚÎŞFe2+ + 2OH-=Fe(OH)2ˇýˇ˘4Fe(OH)2+2H2O+O2=4Fe(OH)3ˇŁ
ąĘ´đ°¸ÎŞŁşFe2+ + 2OH-=Fe(OH)2ˇýŁ» 4Fe(OH)2+2H2O+O2=4Fe(OH)3Ł»
˘Ű·ÖÎöĆ˝şâŁ¬![]() Ł¬ĽÓČëĽîÖĐşÍÁňËᣬ´ŮʹƽşâŐýĎňŇƶŻŁ¬Ěá¸ß·°µÄÝÍȡÂĘŁ¬
Ł¬ĽÓČëĽîÖĐşÍÁňËᣬ´ŮʹƽşâŐýĎňŇƶŻŁ¬Ěá¸ß·°µÄÝÍȡÂĘŁ¬
ąĘ´đ°¸ÎŞŁşĽÓČëĽîÖĐşÍÁňËᣬ´ŮʹƽşâŐýĎňŇƶŻŁ¬Ěá¸ß·°µÄÝÍȡÂĘŁ»
˘Üµç˝â·¨ľ«Á¶·°Ł¬ÓĂ´Ö·°×÷ŃôĽ«Ł¬·˘ÉúŃő»Ż·´Ó¦Ł¬
ąĘ´đ°¸ÎŞŁşŃôĽ«ˇŁ

 µĽŃ§˝ĚłĚ¸ßÖĐĐ¿αęϵÁĐ´đ°¸
µĽŃ§˝ĚłĚ¸ßÖĐĐ¿αęϵÁд𰸡ľĚâÄżˇżNF3ĘÇ΢µç×Óą¤ŇµÖĐłŁÓõÄŇ»ÖÖµČŔë×ÓĘ´żĚĆřĚ壬ľßÓĐ˝ĎÇżµÄŃő»ŻĐÔŁ¬ą¤ŇµÉú˛úNF3łŁÓõķ˝·¨ÓĐĆřһҺ·´Ó¦·¨ˇ˘ĆřŇ»ąĚ·´Ó¦·¨şÍµç˝â·¨µČˇŁ
Ł¨1Ł©ĆřһҺ·´Ó¦·¨ÖĐ·˘ÉúµÄÖ÷·´Ó¦şÍ¸±·´Ó¦°üŔ¨Łş
3F2(g)+NH3(l)=NF3(g)+3HF(l) ˇ÷H1
3F2(g)+NH4HF2(l)=NF3(g)+5HF(l) ˇ÷H2
4F2(g)+2NH3(l)=N2F2(g)+6HF(l) ˇ÷H3
NH3(l)+2HF(l)=NH4HF2(l) ˇ÷H4
ˇ÷H1=_____ˇŁ˛ż·ÖĽüÄÜĘýľÝČçϱíËůĘľŁ¬ˇ÷H3=_____kJ/molˇŁ
»ŻŃ§Ľü | N-N | N=N | N | H-F | F-F | N-H | N-F |
ĽüÄÜŁ¨kJ/molŁ© | 159 | 456 | 946 | 565 | 153 | 389 | 272 |
Ł¨2Ł©ĆřŇ»ąĚ·´Ó¦·¨Ö÷ŇŞ°üŔ¨Á˝˛˝·´Ó¦Łş
(NH4)3AlF6(s)+6F2(g)![]() 2NF3(g)+8HF(g)+NH4AlF4(s) ·´Ó¦˘ń
2NF3(g)+8HF(g)+NH4AlF4(s) ·´Ó¦˘ń
NH4AlF4(s)+3F2(g)![]() NF3(g)+4HF(g)+ AlF3(s) ·´Ó¦˘ň
NF3(g)+4HF(g)+ AlF3(s) ·´Ó¦˘ň
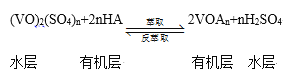
·´Ó¦IµÄĆ˝şâłŁĘýK1şÍ·´Ó¦IIµÄĆ˝şâłŁĘýµÄąŘϵĘÇ___ˇŁČôÔÚşăΡ˘şăČݵÄĂܱŐČÝĆ÷ÖĐÄŁÄâĆřŇ»ąĚ·´Ó¦·¨Ł¨ąĚĚĺ×ăÁż)Ł¬ĆđʼʱF2µÄŨ¶ČÎŞ5mol/LŁ¬·´Ó¦ąýłĚÖĐČÝĆ÷ÖĐѹǿһËćʱĽä±ä»ŻÇúĎßČçÍĽËůĘľŁ¬ÔňÇ°2minµÄĆ˝ľů·´Ó¦ËŮÂĘv(NF3)=___mol/(Lmin)Ł¬¸ĂζČĎÂK2=___ˇŁ
Ł¨3Ł©µç˝â·¨ĘÇͨąýµç˝âş¬·úµÄČŰČÚŃÎÉú˛úNF3Ł¬ĆäÔŔíČçÍĽËůĘľˇŁaĐčŇŞ˝ÓµçÔ´µÄ____(ĚŐýĽ«ˇ±»ňˇ°¸şĽ«ˇ±)Ł¬ÉúłÉĆřĚĺAµÄµçĽ«·´Ó¦ĘÇ____ˇŁ
Ł¨4Ł©ÓĂNF3¶Ô¶ŕľ§ąčµç×ÓÔŞĽţ˝řĐĐĘ´żĚʱ˛»»áÔÚµç×ÓÔŞĽţ±íĂćĐÎłÉČκβĐÁôÎĆäÔŇňĘÇ_____ˇŁŁ¨ÓĂ»ŻŃ§ÓĂÓď˝âĘÍŁ©
ˇľĚâÄżˇżµç˝âÖĘË®ČÜŇşÖĐ´ćÔÚµçŔëĆ˝şâˇ˘Ë®˝âĆ˝şâˇ˘ČÜ˝âĆ˝şâŁ¬Çë»Ř´đĎÂÁĐÎĘĚ⡣
Ł¨1Ł©ŇŃÖŞ˛ż·ÖČőËáµÄµçŔëĆ˝şâłŁĘýČçĎÂ±íŁş
ČőËá | HCOOH | HCN | H2CO3 |
µçŔëĆ˝şâłŁĘýŁ¨25ˇćŁ© | Ka=1.77ˇÁ10Ł4 | Ka=5.0ˇÁ10Ł10 | Ka1=4.3ˇÁ10Ł7 Ka2=5.6ˇÁ10Ł11 |
˘ŮHCOONaˇ˘NaCNˇ˘NaHCO3ˇ˘Na2CO3Őâ4ÖÖČÜŇşÖĐŇőŔë×Ó˝áşĎÖĘ×ÓÄÜÁ¦×îÇżµÄĘÇ__________________ˇŁ
˘ÚĚĺ»ýĎŕͬˇ˘c(H+)ĎŕͬµÄČýÖÖËáČÜŇş˘ŮHCOOHŁ»˘ÚHCNŁ»˘ŰH2SO4·Ö±đÓëͬŨ¶ČµÄNaOHČÜŇşÍęČ«Öкͣ¬ĎűşÄNaOHČÜŇşµÄĚĺ»ýÓÉ´óµ˝ĐˇµÄĹĹÁĐËłĐňĘÇ(ĚîĐňşĹ) _____________Ł»
Ł¨2Ł©Ň»¶¨Ĺ¨¶ČµÄNaCNČÜŇşpH=9Ł¬ÓĂŔë×Ó·˝łĚĘ˝±íĘľłĘĽîĐÔµÄÔŇňĘÇ___________Ł»´Ëʱc(HCN)/c(CN-)=______________ˇŁ
Ł¨3Ł©ŇŃÖŞCaCO3µÄKsp=2.8ˇÁl0-9Ł¬ĎÖ˝«Ĺ¨¶ČÎŞ5.6ˇÁl0-4mol/LNa2CO3ČÜŇşÓëCaCl2ČÜŇşµČĚĺ»ý»ěşĎŁ¬ÔňÉúłÉCaCO3łÁµíËůĐčCaCl2ČÜŇşµÄ×îСŨ¶ČÎŞ__________ mol/LˇŁ
ˇľĚâÄżˇżÁ×ËáŃÇĚúﮣ¨LiFePO4Ł©µçłŘĘÇĐÂÄÜÔ´ĆűłµµÄ¶ŻÁ¦µçłŘ֮һˇŁ·ĎľÉµçłŘŐýĽ«Ć¬Ł¨Á×ËáŃÇĚúﮡ˘ĚżşÚşÍÂÁ˛µČŁ©żÉÔŮÉúŔűÓĂŁ¬Ć乤ŇŐÁ÷łĚČçĎÂŁş

ŇŃÖŞŁşĚĽËáď®ÔÚË®ÖеÄČÜ˝â¶ČŁ¬0ˇćʱΪ1.54gŁ¬90ˇćʱΪ0.85gŁ¬100ˇćʱΪ0.71gˇŁ
Ł¨1Ł©ÉĎĘöÁ÷łĚÖĐÖÁÉŮĐčŇŞľąý______´ÎąýÂ˲Ů×÷ˇŁ
Ł¨2Ł©ˇ°Ńő»Żˇ±·˘Éú·´Ó¦µÄŔë×Ó·˝łĚʽΪ__________Ł»ČôÓĂHNO3´úĚćH2O2˛»×ăÖ®´¦ĘÇ_____ˇŁ
Ł¨3Ł©˘ŮŇŃÖŞKsp[Fe(OH)3]=2.6ˇÁ10-39ˇŁłŁÎÂĎÂŁ¬ÔÚFe(OH)3Đü×ÇŇşÖĐŁ¬µ±ČÜŇşµÄpH=3.0ʱŁ¬Fe3+µÄŨ¶ČÎŞ________mol/LˇŁ
˘ÚʵĽĘÉú˛úąýłĚÖĐŁ¬ˇ°µ÷˝ÚpHˇ±ÉúłÉłÁµíʱŁ¬ČÜŇşpHÓë˝đĘôÔŞËصijÁµí°Ů·ÖÂĘ(¦Ř)µÄąŘϵČçĎÂ±íŁş
pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
¦Ř(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
¦Ř(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
Ôň×îĽŃµÄłÁµípH=________ˇŁ
Ł¨4Ł©ˇ°łÁď®" ʱµÄζČӦѡŁ¨Ěî±ęşĹŁ©______ÎŞŇËŁ¬˛˘ÓĂ___Ď´µÓŁ¨ĚČČË®" »ňˇ°ŔäË®"Ł©ˇŁ
aŁ®90ˇć bŁ®60 ˇć cŁ®30 ˇć dŁ®0 ˇć
Ł¨5Ł©Á×ËáŃÇĚú﮵çłŘÔÚą¤×÷ʱŁ¬ŐýĽ«·˘ÉúLiFePO4şÍFePO4µÄת»ŻŁ¬¸ĂµçłŘ·ĹµçʱŐýĽ«µÄµçĽ«·´Ó¦Ę˝ÎŞ________ˇŁ
Ł¨6Ł©ą¤ŇµÉĎżÉŇÔÓĂFePO4ˇ˘Li2CO3şÍH2C2O4×÷ÔÁϸßαşÉŐÖƱ¸ LiFePO4Ł¬¸Ă·´Ó¦µÄ»ŻŃ§·˝łĚʽΪ________