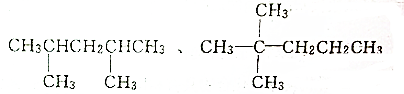题目内容
3.下列说法或表示方法中正确的是( )| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)→C(石墨)+119KJ 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)→2H2O(l)+285.8KJ | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)→H2O(l)+53.7KJ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ |
分析 A、硫蒸气变化为硫固体为放热过程;
B、能量越低越稳定;
C、2gH2即1mol完全燃烧生成液态水,放出285.8KJ热量;
D、浓硫酸溶解放热.
解答 解:A、硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,故A错误;
B、由C(金刚石)→C(石墨)+119KJ 可知,金刚石的能量比石墨高,石墨比金刚石稳定,故B错误;
C、2gH2即1mol完全燃烧生成液态水,放出285.8KJ热量,则氢气的燃烧热热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ/mol,故C错误;
D、在稀溶液中:H+(aq)+OH-(aq)→H2O(l)+53.7KJ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,由于浓硫酸溶解要放出热量,所以反应放出的热量大于53.7KJ,故D正确;
故选D.
点评 本题考查了反应热和焓变、燃烧热的热化学方程式等,题目综合性较强,侧重于基础知识的考查,难度一般,注意反应热的分类和特点.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 加入铝粉放出H2的溶液中:Al3+、K+、SO42-、Cl- | |
| B. | 1.0mol•L-1的KNO3溶液中:Na+、Fe2+、Cl-、SO42- | |
| C. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、HCO3- | |
| D. | 水电离产生的c(OH-)=10-12 mol•L-1的溶液中:K+、Cu2+、SO42-、NO3- |
18.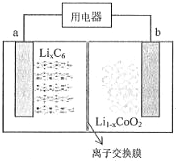 某聚合物锂离子充电电池放电时的反应为:Li1-xCoO2+LixC6=6C+LiCoO2,(LixC6表示锂原子嵌入石墨形成的复合材料)其工作原理如图所示,下列说法正确的是( )
某聚合物锂离子充电电池放电时的反应为:Li1-xCoO2+LixC6=6C+LiCoO2,(LixC6表示锂原子嵌入石墨形成的复合材料)其工作原理如图所示,下列说法正确的是( )
 某聚合物锂离子充电电池放电时的反应为:Li1-xCoO2+LixC6=6C+LiCoO2,(LixC6表示锂原子嵌入石墨形成的复合材料)其工作原理如图所示,下列说法正确的是( )
某聚合物锂离子充电电池放电时的反应为:Li1-xCoO2+LixC6=6C+LiCoO2,(LixC6表示锂原子嵌入石墨形成的复合材料)其工作原理如图所示,下列说法正确的是( )| A. | 放电时,电子从b极流向a极 | |
| B. | 放电时,a极脱出的离子通过阴离子交换膜从左向右移动 | |
| C. | 充电时,b极发生的反应为:LiCoO2-xe-=Li1-xCoO2+xLi+ | |
| D. | 充电时,每转移x mol 电子,产生6mol碳单质 |
8. 把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )
把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )
 把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )
把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )| A. | Ⅰ和Ⅲ附近 | B. | Ⅰ和Ⅳ附近 | C. | Ⅱ和Ⅲ附近 | D. | Ⅱ和Ⅳ附近 |
15.氰气(CN)2性质与卤素相似,分子中4个原子处于同一直线.下列叙述正确的是( )
| A. | 分子中只存在极性键 | B. | 在氰气中N、C的化合价为0 | ||
| C. | CN的电子式: | D. | 能与烯烃发生加成反应 |
10.常温下,下列有关叙述正确的是( )
| A. | 在0.1mol•L-1Na2C2O4溶液中:2c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4) | |
| B. | 向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| D. | 浓度均为0.1 mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-) |
10.下列装置能达到对应实验目的是( )
| A. |  分离碘与沙子 | B. | 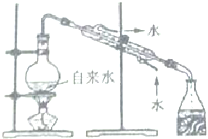 实验室制取蒸馏水 | ||
| C. | 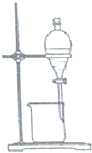 乙醇提取碘水中的碘 | D. |  收集氨气 |