题目内容
14.主链含有5个碳原子,有两个甲基作支链的烷烃有4种,其中两种的结构简式是如图,试写出其他几种分子的结构简式,并用系统命名法命名.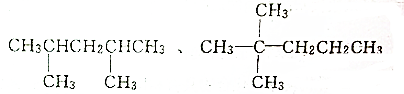
分析 根据已知有机物的结构简式可判断,可以通过让两个甲基按照由心到边移动,即可得到同分异构体的结构简式,利用烷烃的系统命名法命名.
解答 解:根据已知有机物的结构简式可判断,可以通过让两个甲基按照由心到边移动,即可得到同分异构体的结构简式,所以共计是4种、另外两种分别是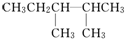 、
、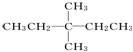 ,名称分别是2,3二甲基戊烷和3,3二甲基戊烷;
,名称分别是2,3二甲基戊烷和3,3二甲基戊烷;
故答案为:4;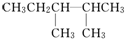 2,3二甲基戊烷;
2,3二甲基戊烷; 3,3二甲基戊烷.
3,3二甲基戊烷.
点评 本题主要考查的是烷烃同分异构体的书写以及烷烃的命名,难度不大,知道主链与支链的个数,可以采取由心到边的书写方法.

| A. | 使用含有氯化钠的融雪剂会加快桥梁的腐蚀 | |
| B. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水机明矾可以使海水淡化 | |
| C. | 煤经过气化、液化等物理变化可得到清洁燃料 | |
| D. | 棉花、羊毛、木材和草类的主要成分都是纤维素 |
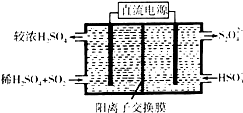 (1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
(1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②请写出Na2SO3溶液中离子浓度大小关系:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
(2)利用图示装置(电极均为惰性电极)吸收SO2,由阴极排出的溶液可吸收NO2.
①阴极的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O.
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成.写出该反应离子方程式:4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O.
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收的产物反应,得到一种复合肥.
①该复合肥料可能的化学式为(NH4)3PO4(或(NH4)2HPO4或NH4H2PO4)(只写一种).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”“碱”或“中”).已知常温下NH3•H2O的Kb=1.8×10-5mol•L-1,H2SO3的Ka1=1.3×10-2mol•L-1Ka2=6.3×10-8mol•L-1.
③当氨水吸收SO2至恰好完全反应形成正盐时,反应过程中H2O的电离平衡移动方向为向右(填“向左”“向右”或“不”).
 ,下列关于该有机物性质的说法错误的是( )
,下列关于该有机物性质的说法错误的是( )| A. | 能跟NaOH溶液反应 | |
| B. | 1mol该有机物与足量的钠反应产生2mol H2 | |
| C. | 能发生酯化反应 | |
| D. | 能使酸性KMnO4溶液褪色 |
| A. | 单质氧化性的强弱 | |
| B. | 单质沸点的高低 | |
| C. | 单质与氢气化合的难易 | |
| D. | 最高价氧化物对应的水化物酸性的强弱 |
(1)下列关于实验的叙述中正确的有 (填字母)。
A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抹布灭火 |
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 |
C.先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 |
D.把试剂瓶中的Na2CO3溶液倒入试管中,发现取量过多,为了不浪费,又把多余的试剂倒入原试剂瓶中 |
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
F.使用分液漏斗前要检查其是否漏水
G.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液中的水全部加热蒸干
(2)某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。
现将该浓硫酸配制成100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:
a.胶头滴管 b.烧瓶 c.烧杯 d.药匙 e.量筒 f.托盘天平
请回答下列问题:
① 配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有 (写仪器名称)。
② 配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用 (填序号)规格的量筒。
a.10 mL b.50 mL c.100 mL
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)→C(石墨)+119KJ 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)→2H2O(l)+285.8KJ | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)→H2O(l)+53.7KJ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ |