题目内容
现有H2S、NH3、CH4三种气体,它们分别都含有相同数目的氢原子,则三种气体的物质的量之比为( )
A. 1∶1∶1 B.2∶3∶4 C.6∶4∶3 D.6∶3∶4
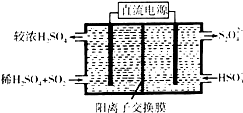 (1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
(1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②请写出Na2SO3溶液中离子浓度大小关系:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
(2)利用图示装置(电极均为惰性电极)吸收SO2,由阴极排出的溶液可吸收NO2.
①阴极的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O.
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成.写出该反应离子方程式:4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O.
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收的产物反应,得到一种复合肥.
①该复合肥料可能的化学式为(NH4)3PO4(或(NH4)2HPO4或NH4H2PO4)(只写一种).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”“碱”或“中”).已知常温下NH3•H2O的Kb=1.8×10-5mol•L-1,H2SO3的Ka1=1.3×10-2mol•L-1Ka2=6.3×10-8mol•L-1.
③当氨水吸收SO2至恰好完全反应形成正盐时,反应过程中H2O的电离平衡移动方向为向右(填“向左”“向右”或“不”).
| A. | 单质氧化性的强弱 | |
| B. | 单质沸点的高低 | |
| C. | 单质与氢气化合的难易 | |
| D. | 最高价氧化物对应的水化物酸性的强弱 |
(1)下列关于实验的叙述中正确的有 (填字母)。
A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抹布灭火 |
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 |
C.先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 |
D.把试剂瓶中的Na2CO3溶液倒入试管中,发现取量过多,为了不浪费,又把多余的试剂倒入原试剂瓶中 |
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
F.使用分液漏斗前要检查其是否漏水
G.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液中的水全部加热蒸干
(2)某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。
现将该浓硫酸配制成100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:
a.胶头滴管 b.烧瓶 c.烧杯 d.药匙 e.量筒 f.托盘天平
请回答下列问题:
① 配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有 (写仪器名称)。
② 配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用 (填序号)规格的量筒。
a.10 mL b.50 mL c.100 mL
下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法。正确的一组是 ( )
序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
① | KNO3 | KOH | 加入FeCl3溶液,并过滤 |
② | Fe(NO3)2溶液 | AgNO3溶液 | 加入足量铁粉,并过滤 |
③ | O2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | CaO | CaCO3 | 加入稀盐酸,再蒸发 |
A.①④ B.② C.②④ D.②③
| A. | (CH3COO)2Pb+H2S→PbS↓+2CH3COOH | |
| B. | Pb2++2CH3COO-+H2S→PbS↓+2CH3COOH | |
| C. | Pb2++H2S→PbS↓+2H+ | |
| D. | Pb2++2CH3COO-+2H++S2-→PbS↓+2CH3COOH |
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)→C(石墨)+119KJ 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)→2H2O(l)+285.8KJ | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)→H2O(l)+53.7KJ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ |


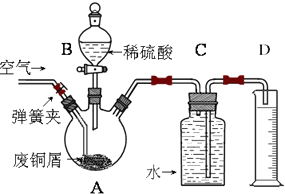 一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.