题目内容
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 加入铝粉放出H2的溶液中:Al3+、K+、SO42-、Cl- | |
| B. | 1.0mol•L-1的KNO3溶液中:Na+、Fe2+、Cl-、SO42- | |
| C. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、HCO3- | |
| D. | 水电离产生的c(OH-)=10-12 mol•L-1的溶液中:K+、Cu2+、SO42-、NO3- |
分析 A.加入铝粉放出H2的溶液中存在大量氢离子或氢氧根离子,铝离子与氢氧根离子反应;
B.四种离子之间不反应,都不与硝酸钾反应;
C.铁离子与碳酸氢根离子发生双水解反应;
D.水电离产生的c(OH-)=10-12 mol•L-1的溶液中存在大量的氢离子或氢氧根离子,铁离子与氢氧根离子反应.
解答 解:A.加入铝粉放出H2的溶液为酸性或强碱性溶液,Al3+与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.Na+、Fe2+、Cl-、SO42-之间不发生反应,都不与KNO3反应,在溶液中能够大量共存,故B正确;
C.Fe3+、HCO3-之间发生双水解反应生成氢氧化铁沉淀和二氧化碳气体,在溶液中不能大量共存,故C错误;
D.该溶液中存在大量氢离子或氢氧根离子,Cu2+与氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

 ,下列关于该有机物性质的说法错误的是( )
,下列关于该有机物性质的说法错误的是( )| A. | 能跟NaOH溶液反应 | |
| B. | 1mol该有机物与足量的钠反应产生2mol H2 | |
| C. | 能发生酯化反应 | |
| D. | 能使酸性KMnO4溶液褪色 |
(1)下列关于实验的叙述中正确的有 (填字母)。
A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抹布灭火 |
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 |
C.先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 |
D.把试剂瓶中的Na2CO3溶液倒入试管中,发现取量过多,为了不浪费,又把多余的试剂倒入原试剂瓶中 |
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
F.使用分液漏斗前要检查其是否漏水
G.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液中的水全部加热蒸干
(2)某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。
现将该浓硫酸配制成100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:
a.胶头滴管 b.烧瓶 c.烧杯 d.药匙 e.量筒 f.托盘天平
请回答下列问题:
① 配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有 (写仪器名称)。
② 配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用 (填序号)规格的量筒。
a.10 mL b.50 mL c.100 mL
下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法。正确的一组是 ( )
序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
① | KNO3 | KOH | 加入FeCl3溶液,并过滤 |
② | Fe(NO3)2溶液 | AgNO3溶液 | 加入足量铁粉,并过滤 |
③ | O2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | CaO | CaCO3 | 加入稀盐酸,再蒸发 |
A.①④ B.② C.②④ D.②③
| A. | (CH3COO)2Pb+H2S→PbS↓+2CH3COOH | |
| B. | Pb2++2CH3COO-+H2S→PbS↓+2CH3COOH | |
| C. | Pb2++H2S→PbS↓+2H+ | |
| D. | Pb2++2CH3COO-+2H++S2-→PbS↓+2CH3COOH |
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)→C(石墨)+119KJ 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)→2H2O(l)+285.8KJ | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)→H2O(l)+53.7KJ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ |

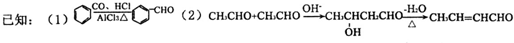
 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +nH2O.
+nH2O. 或
或 .
.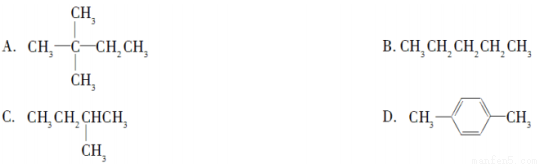
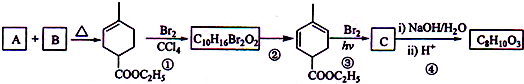
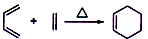
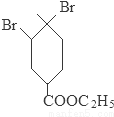 +2NaOH
+2NaOH
 +2NaBr+2H2O;
+2NaBr+2H2O;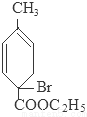 +2H2O
+2H2O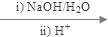
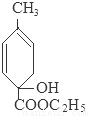 +C2H5OH+HBr:
+C2H5OH+HBr: .
.