题目内容
16.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 水电离出的c(H+)=1.0×10-13mol/L的溶液中,Na+、NH4+、Cl-、SO42- | |
| B. | 滴入甲基橙试液变红色的溶液中:Cl-、AlO2-、HCO3-、NH4+ | |
| C. | 加入少量KSCN后变为红色的溶液中:K+、Mg2+、I-、NO3- | |
| D. | 无色透明的溶液中:CH3COO-、CO32-、K+、Na+ |
分析 A.水电离出的c(H+)=1.0×10-13mol/L的溶液中存在大量氢离子或氢氧根离子,铵根离子与氢氧根离子反应;
B.滴入甲基橙试液变红色的溶液中存在大量氢离子,碳酸氢根离子酸性大于氢氧化铝,偏铝酸根离子与碳酸氢根离子反应生成氢氧化铝沉淀和碳酸根离子,且偏铝酸根离子和碳酸氢根离子都与氢离子反应;铵根离子与偏铝酸根离子发生双水解反应;
C.加入少量KSCN后变为红色的溶液中存在铁离子,铁离子能够氧化碘离子;
D.四种离子之间不反应,且为无色透明溶液.
解答 解:A.水电离出的c(H+)=1.0×10-13mol/L的溶液为酸性或碱性溶液,铵根离子与碱性溶液反应,在溶液中不能大量共存,故A错误;
B.滴入甲基橙试液变红色的溶液为酸性溶液,溶液中存在大量氢离子,AlO2-、HCO3-之间反应生成氢氧化铝沉淀和碳酸根离子,AlO2-、HCO3-都与氢离子反应,AlO2-、NH4+发生双水解反应,在溶液中不能大量共存,故B错误;
C.加入少量KSCN后变为红色的溶液中存在铁离子,铁离子具有氧化性,能够氧化I-,在溶液中不能大量共存,故C错误;
D.CH3COO-、CO32-、K+、Na+之间不反应,都是无色离子,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;是“可能”共存,还是“一定”共存等.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
4.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:

(1)工业生产硫酸的第一步反应如下,请配平该化学方程式并用单线桥法标注电子转移的方向和数目:
4FeS2+11O2$\frac{高温}{\;}$8SO2+2Fe2O3
(2)写出生产过程中XFe,YHCl (填化学式).
(3)产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的eCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.如此再重复二次测得数据如下:
( 已知:CuCl+FeCl3 ══CuCl2 +FeCl2 Fe2++Ce4+══Fe3++Ce3+)
④数据处理:计算得CuCl的纯度为95%.(平行实验结果相差不能超过0.3%)

(1)工业生产硫酸的第一步反应如下,请配平该化学方程式并用单线桥法标注电子转移的方向和数目:
4FeS2+11O2$\frac{高温}{\;}$8SO2+2Fe2O3
(2)写出生产过程中XFe,YHCl (填化学式).
(3)产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的eCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.如此再重复二次测得数据如下:
( 已知:CuCl+FeCl3 ══CuCl2 +FeCl2 Fe2++Ce4+══Fe3++Ce3+)
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
11.课外兴趣小组设计如图所示装置,用粗铁粒与1890g•L-1(质量分数为5%)的硝酸反应制取NO气体.请回答有关问题.

(1)1890g•L-1硝酸的物质的量浓度为1.5mol•L-1.
(2)NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应,NO与空气密度接近.
(3)当打开止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是金属不断溶解,有气体产生逐渐变为红棕色.B装置烧杯中液体的作用是吸收氮的氧化物.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(4)该实验中,若去掉B装置,对实验结果是否有影响?无影响.
(5)将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(2amol或3amol或2amol~3amol)(用含a和b的代数式表示).
(6)完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管.0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:

(1)1890g•L-1硝酸的物质的量浓度为1.5mol•L-1.
(2)NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应,NO与空气密度接近.
(3)当打开止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是金属不断溶解,有气体产生逐渐变为红棕色.B装置烧杯中液体的作用是吸收氮的氧化物.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(4)该实验中,若去掉B装置,对实验结果是否有影响?无影响.
(5)将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(2amol或3amol或2amol~3amol)(用含a和b的代数式表示).
(6)完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管.0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
1.原子序数依次递增的短周期元素X、Y、Z、W存在以下关系:①原子最外层电子数之和为20;②X与Y、Z、W位于相邻周期;③Z原子最外层电子数是Y原子最外层电子数的3倍,也是X原子内层电子数的3倍.以下判断错误的是(注:不考虑0族元素)( )
| A. | X的氢化物的水溶液呈酸性 | |
| B. | Y的氧化物和氢氧化物均不溶于水 | |
| C. | Z的最高价含氧酸的浓溶液有强氧化性 | |
| D. | W原子半径在同周期中最小 |
8.在下列晶体中,一定存在共价键的是( )
| A. | 离子晶体 | B. | 分子晶体 | C. | 原子晶体 | D. | 金属晶体 |
5.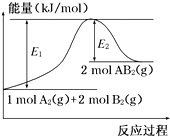 已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
 已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热 | |
| B. | 该反应的△H=-(E1-E2)kJ/mol | |
| C. | 该反应中反应物的键能总和大于生成物的键能总和 | |
| D. | 断裂1 mol A-A和2 mol B-B放出E1 kJ能量 |
6.下列属于金属材料的是( )
| A. | 铝合金 | B. | 光导纤维 | C. | 玻璃钢 | D. | 氮化硅陶瓷 |
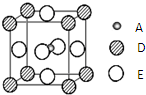 已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.
已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.