题目内容
1.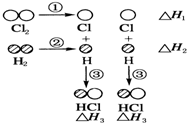 下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):
下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能/kJ•mol-1 | 436 | 243 | 431 |
(1)△H1=+243kJ•mol-1,△H2=+436kJ•mol-1,△H3=-431kJ•mol-1.
(2)该反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ•mol-1.
分析 化学反应中,化学键断裂要吸收能量,形成化学键要放出能量,反应热等于反应物的总键能减生成物的总键能,以此解答该题.
解答 解:(1)化学键断裂要吸收能量,形成化学键要放出能量,则由表中数据可知△H1=+243 kJ•mol-1,△H2=+436 kJ•mol-1,△H3=-431 kJ•mol-1,
故答案为:+243;+436;-431;
(2)在反应中H2(g)+Cl2(g)=2HCl(g),反应热等于反应物的总键能减生成物的总键能,则△H=(436+243-2×431)kJ/mol=-183 kJ•mol-1,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ•mol-1.
点评 本题综合考查反应热与焓变,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意把握反应的特点以及反应热的计算放方法.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
11.下列物质的保存方法不正确的是( )
| A. | 氯水存放在带橡胶塞的棕色广口瓶中 | |
| B. | 少量钠保存在煤油中 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 碳酸钠固体保存在广口瓶中 |
12.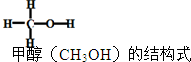 已知:2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,其他相关数据如表
已知:2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,其他相关数据如表
则CO中碳氧键的键能为( )
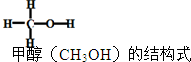 已知:2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,其他相关数据如表
已知:2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,其他相关数据如表| 共价键 | H-H | C-H | C-O | O-H |
| 键能(kJ/mol) | 436 | 414 | 326 | 464 |
| A. | 1070 kJ/mol | B. | 1080 kJ/mol | C. | 1090 kJ/mol | D. | 1100 kJ/mol |
9.下列说法中,正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 燃煤发电是煤的综合利用的重要途径 | |
| C. | 反应物的总能量大于生成物的总能量的化学反应是放热反应 | |
| D. | 化学键的断裂和形成与化学变化中的能量变化无关 |
16.关于糖类、油脂和蛋白质,以下叙述正确的是( )
| A. | 植物油能使溴的四氯化碳溶液褪色 | |
| B. | 葡萄糖能发生氧化反应和水解反应 | |
| C. | 蔗糖和淀粉都是高分子化合物 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
6.低合金高强度钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等合金元素,下列有关说法正确的是( )
| A. | 工业上利用热还原法冶炼金属Fe、Cr、Mn | |
| B. | Fe位于元素周期表的第四周期、第ⅧB族 | |
| C. | ${\;}_{22}^{46}$TiO2、${\;}_{22}^{48}$TiO2、${\;}_{22}^{50}$TiO2互为同位素 | |
| D. | ${\;}_{41}^{92}$Nb3+原子核内有51个中子,核外有44个电子 |
13.原子序数在20号以前的元素,原子最外层电子数等于次外层电子数的有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |

 +RCH2I→
+RCH2I→
 .
. (不要求立体异构).
(不要求立体异构). .
. .(写结构简式)
.(写结构简式)