题目内容
13.原子序数在20号以前的元素,原子最外层电子数等于次外层电子数的有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 20号以前的元素最多有4个电子层,如有次外层,至少有2个电子层,根据核外电子排布规律,当有2个电子层时,符合题意的是Be;当有3个电子层时,符合题意的是Ar,当有4个电子层时,没有符合题意的.
解答 解:20号以前的元素最多有4个电子层,如有次外层,至少有2个电子层,根据核外电子排布规律,当有2个电子层时,符合题意的是Be;当有3个电子层时,符合题意的是Ar,当有4个电子层时,没有符合题意的,所以原子序数在20号以前的元素原子的最外层电子数等于次外层电子数的有Be、Ar两种,
故选B.
点评 本题考查原子核外电子的排布,题目难度不大,本题注意把握原子核外电子的排布特点,学习中注意相关知识的积累.

练习册系列答案
相关题目
3.将2molA和1mol B充入某密闭容器中发生反应:2A(g)+B(g)?xC(g),达到化学平衡后,C的体积分数为a.假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是( )
| A. | 若在恒温恒压下,当x=1时按1.5 mol A、1molC作为起始物质,平衡后C的体积分数仍为a | |
| B. | 若在恒温恒容下,当x=2时将2molC作起始物质,平衡后C的体积分数仍为a | |
| C. | 若在恒温恒压下,当x=3时1mol A、1mol B、6molC作起始物质,平衡后C的体积分数仍为a | |
| D. | 若在恒温恒容下,按0.6mol A、0.3mol B、1.4molC作起始物质,平衡后C的体积分数仍为a,则x只能等于2 |
4.燃料电池是目前正在探索的一种新型电池,现在已经使用的氢氧燃料电池的基本反应是:x 极:O2(g)+2H2O(l)+4e-═4OH- y极:2H2(g)+4OH--4e-═4H2O(l) 判断下列说法中正确的是( )
| A. | x极为电池的负极 | B. | x极附近溶液的pH值减小 | ||
| C. | y极发生氧化反应 | D. | 电流由y极流向x极 |
1.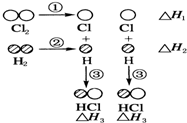 下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):
下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):
H2和Cl2反应生成HCl过程中的热效应可用如图表示,请回答下列问题:
(1)△H1=+243kJ•mol-1,△H2=+436kJ•mol-1,△H3=-431kJ•mol-1.
(2)该反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ•mol-1.
 下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):
下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能/kJ•mol-1 | 436 | 243 | 431 |
(1)△H1=+243kJ•mol-1,△H2=+436kJ•mol-1,△H3=-431kJ•mol-1.
(2)该反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ•mol-1.
8.常温下,等浓度的下列稀溶液:①乙酸、②苯酚、③碳酸、④乙醇、⑤盐酸,它们的pH由小到大排列正确的是( )
| A. | ④②③①⑤ | B. | ⑤③①②④ | C. | ⑤①③②④ | D. | ①②③④⑤ |
2.下列关于常见有机物的说法不正确的是( )
| A. | 乙酸和油脂都能与NaOH溶液反应 | |
| B. | 蛋白质、纤维素、蔗糖、油脂都是高分子化合物 | |
| C. | 淀粉水解与纤维素水解得到的最终产物相同 | |
| D. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
20.下列关于元素周期表的说法,错误的是( )
| A. | 元素周期表是元素按原子序数大小排列而成的 | |
| B. | 元素原子的电子层数等于其所在周期的周期序数 | |
| C. | 元素原子的最外层电子数等于其所在族的族序数 | |
| D. | 元素周期表是元素周期律的具体表现形式 |
 2SO2(g)+O2(g);△H =+196.6 kJ/mol
2SO2(g)+O2(g);△H =+196.6 kJ/mol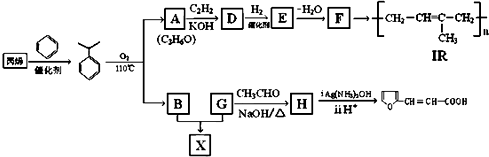
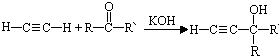
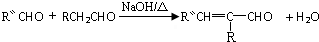
 ,反应类型是加成反应.
,反应类型是加成反应. .
. .
. .
.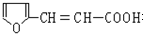 有多种同分异构体,符合下列要求的有6种.
有多种同分异构体,符合下列要求的有6种.