题目内容
20.Na2CO3和NaHCO3有着广泛的应用.试从反应物的用量等角度,回答下列问题:①做面条时,防止面团较长时间储存变酸味,常加入适量的面碱,选用Na2CO3.
②胃溃疡(胃壁溃烂或穿孔)病人的胃酸过多,医生给用Al(OH)3乳胶,既不用苏打,也不用小苏打,其原因是苏打、小苏打都能和盐酸反应生成二氧化碳气体,加重病情.
③用于洗涤餐具及实验室的玻璃仪器等,选用Na2CO3.
分析 ①碳酸钠溶于水显碱性,可以与发酵酸反应;
②苏打、小苏打都能和盐酸反应生成二氧化碳,生成的气体会使胃膨胀,加重胃溃疡的程度;
③苏打溶液比同浓度的小苏打溶液碱性强.
解答 解:①碳酸钠溶于水显碱性,可以与发酵酸反应生成二氧化碳,且中和同样多的酸,苏打比小苏打用量少,故答案为:Na2CO3;
②因为苏打、小苏打都能和盐酸反应生成二氧化碳,生成的气体会使胃膨胀,加重胃溃疡的程度,故胃溃疡的病人不能服用苏打和小苏打,
故答案为:苏打、小苏打都能和盐酸反应生成二氧化碳气体,加重病情;
③用于洗涤餐具及实验室的玻璃仪器等,选用苏打,因为苏打溶液比同浓度的小苏打溶液碱性强,去污能力强,故答案为:Na2CO3.
点评 本题考查元素化合物知识,为高频考点,侧重于化学与生活的考查,有利于培养学生的良好的科学素养,注意相关基础知识的积累,难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
10.
I:(1)第三周期元素M的电离能情况如甲图A所示.则M元素的价层电子排布式是3s2
(2)图B折线c(选填“a”、“b”或“c”)可以表达出第ⅣA族元素氢化物的沸点的变化规律.其中点A表示的分子的化学式为H2O,其沸点较高是因为水分子间可以形成氢键.
(3)COCl2 俗称光气,分子中C原子采取sp2杂化成键;其中分子中的共价键含有C(填序号):
A 2个σ键 1个π键 B 2个键π C 3个σ键、1个π键
Ⅱ:海水中富含氯元素.
(4)KCl广泛应用于医药和农业,KCl晶体中基态的Cl-电子排布式为1s22s22p63s23p6
(5)下列是IA族的Li、Na、K三种金属元素的电离能
则三种金属的氯化物(RCl)的熔点由高到低的顺序为LiCl>NaCl>KCl(用化学式回答),原因是随核电荷数增大,阳离子半径增大,晶格能减小,熔点降低
(6)RCl用作有机机合成催化剂,并用于颜料,防腐等工业.R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如图乙所示.R的元素符号是Cu,每个Cl-周围最近的Cl-12个.已知该晶体密度为1.15 g/cm3,则晶胞中最近的R+和Cl-之间的距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{1.15×6.02×1{0}^{23}}}$cm(NA=6.02×1023/mol,只写出计算表达式即可)

I:(1)第三周期元素M的电离能情况如甲图A所示.则M元素的价层电子排布式是3s2
(2)图B折线c(选填“a”、“b”或“c”)可以表达出第ⅣA族元素氢化物的沸点的变化规律.其中点A表示的分子的化学式为H2O,其沸点较高是因为水分子间可以形成氢键.
(3)COCl2 俗称光气,分子中C原子采取sp2杂化成键;其中分子中的共价键含有C(填序号):
A 2个σ键 1个π键 B 2个键π C 3个σ键、1个π键
Ⅱ:海水中富含氯元素.
(4)KCl广泛应用于医药和农业,KCl晶体中基态的Cl-电子排布式为1s22s22p63s23p6
(5)下列是IA族的Li、Na、K三种金属元素的电离能
| X | Y | Z | |
| 第一电离能(KJ/mol) | 526.2 | 502.8 | 425.2 |
(6)RCl用作有机机合成催化剂,并用于颜料,防腐等工业.R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如图乙所示.R的元素符号是Cu,每个Cl-周围最近的Cl-12个.已知该晶体密度为1.15 g/cm3,则晶胞中最近的R+和Cl-之间的距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{1.15×6.02×1{0}^{23}}}$cm(NA=6.02×1023/mol,只写出计算表达式即可)
11.有500ml 含Na2CO3与Na2SO4的混合溶液,向其中加入足量的BaCl2溶液,得到66.3g白色沉淀,向所得沉淀中加入足量HCl,最后剩余46.6g沉淀,则溶液中Na+的物质的量浓度为( )
| A. | 0.6mol/L | B. | 1mol/L | C. | 1.2mol/L | D. | 0.5mol/L |
8.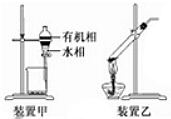 下列实验操作正确的是( )
下列实验操作正确的是( )
 下列实验操作正确的是( )
下列实验操作正确的是( )| A. | 可用磨口玻璃瓶保存NaOH溶液 | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用装置乙加热分解NaHCO3固体 |
12.下列叙述正确的是( )
| A. | 二氧化硫能使溴水褪色,说明二氧化硫具有漂白性 | |
| B. | 漂白粉和明矾都常用于处理自来水,二者的作用的原理相同 | |
| C. | 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可用酸性高锰酸钾溶液 | |
| D. | 金属单质Na、Al、Fe在一定条件下与水反应都生成氢气和对应的碱 |
9.25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法中正确的是( )
| A. | 该溶液的pH一定是9 | B. | 该溶液的溶质可能是可水解的盐 | ||
| C. | 该溶液的溶质可能是酸或碱 | D. | 不可能有这样的溶液 |
10.下列说法正确的是( )
| A. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| C. | H3O+和NH4+具有的电子数相同 | |
| D. | 用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |
