题目内容
10.
I:(1)第三周期元素M的电离能情况如甲图A所示.则M元素的价层电子排布式是3s2
(2)图B折线c(选填“a”、“b”或“c”)可以表达出第ⅣA族元素氢化物的沸点的变化规律.其中点A表示的分子的化学式为H2O,其沸点较高是因为水分子间可以形成氢键.
(3)COCl2 俗称光气,分子中C原子采取sp2杂化成键;其中分子中的共价键含有C(填序号):
A 2个σ键 1个π键 B 2个键π C 3个σ键、1个π键
Ⅱ:海水中富含氯元素.
(4)KCl广泛应用于医药和农业,KCl晶体中基态的Cl-电子排布式为1s22s22p63s23p6
(5)下列是IA族的Li、Na、K三种金属元素的电离能
| X | Y | Z | |
| 第一电离能(KJ/mol) | 526.2 | 502.8 | 425.2 |
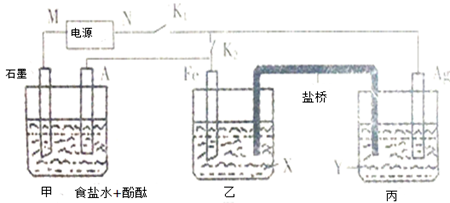
(6)RCl用作有机机合成催化剂,并用于颜料,防腐等工业.R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如图乙所示.R的元素符号是Cu,每个Cl-周围最近的Cl-12个.已知该晶体密度为1.15 g/cm3,则晶胞中最近的R+和Cl-之间的距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{1.15×6.02×1{0}^{23}}}$cm(NA=6.02×1023/mol,只写出计算表达式即可)
分析 I(1)第三周期元素M的第三电离能剧增,说明最外层电子数为2,故M为Mg;
(2)第ⅣA族元素氢化物为分子晶体,分子之间不存在氢键,相对分子质量越大,沸点越高;氢化物A的沸点为100℃,则A为水,由于水分子之间存在氢键,其沸点比较高;
(3)COCl2的结构式为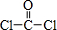 ,分子中C原子杂化轨道数目为3,单键为σ键,双键含有1个σ键、1个π键;
,分子中C原子杂化轨道数目为3,单键为σ键,双键含有1个σ键、1个π键;
Ⅱ(4)Cl-离子核外电子数为18,根据构造原理书写核外电子排布式;
(5)X、Y、Z的价层电子构型为nS1,处于ⅠA族,自上而下第一电离能减小,故原子序数X>Y>Z,它们的氯化物(RCl)属于离子化合物,它们的氯化物(RCl)属于离子化合物,阳离子半径越小,晶格能越大,熔沸点越高;
(6)R+中所有电子正好充满K、L、M 三个电子层,则R原子核外电子数为2+8+18+1=29,故R为Cu;
以顶点Cl-研究,与之最近的Cl-处于面心,每个顶点为8个晶胞共用,每个面心为两个晶胞共用有;
晶胞中最近的R+和Cl-处于体对角线上,距离为体对角线长的$\frac{1}{4}$,根据均摊法计算晶胞中原子数目,进而计算晶胞质量,再根据V=$\frac{m}{ρ}$计算晶胞体积,晶胞棱长a=$\root{3}{V}$,故R+和Cl-距离=$\frac{1}{4}$×$\sqrt{{3a}^{2}}$=$\frac{\sqrt{3}}{4}$a.
解答 解:I(1)第三周期元素M的第三电离能剧增,说明最外层电子数为2,故M为Mg,价层电子排布式是:3s2,
故答案为:3s2;
(2)第ⅣA族元素氢化物为分子晶体,分子之间不存在氢键,相对分子质量越大,沸点越高,故折线c表示第ⅣA族元素氢化物沸点;氢化物A的沸点为100℃,则A为水,由于水分子之间形成氢键,其沸点比较高,
故答案为:c;H2O;水分子间可以形成氢键;
(3)COCl2的结构式为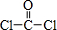 ,分子中C原子杂化轨道数目为3,C原子采取sp2杂化,单键为σ键,双键含有1个σ键、1个π键.分子中含有3个σ键、1个π键,
,分子中C原子杂化轨道数目为3,C原子采取sp2杂化,单键为σ键,双键含有1个σ键、1个π键.分子中含有3个σ键、1个π键,
故答案为:sp2;C;
Ⅱ(4)Cl-离子核外电子数为18,核外电子排布式为1s22s22p63s23p6,
故答案为:1s22s22p63s23p6;
(5)X、Y、Z的价层电子构型为nS1,处于ⅠA族,自上而下第一电离能减小,故原子序数X>Y>Z,故离子半径X>Y>Z,则晶格能LiCl>NaCl>KCl,故熔点LiCl>NaCl>KCl,
故答案为:LiCl>NaCl>KCl;随核电荷数增大,阳离子半径增大,晶格能减小,熔点降低;
(6)R+中所有电子正好充满K、L、M 三个电子层,则R原子核外电子数为2+8+18+1=29,故R为Cu;
以顶点Cl-研究,与之最近的Cl-处于面心,每个顶点为8个晶胞共用,每个面心为两个晶胞共用,故每个Cl-周围最近的Cl- 有$\frac{8×3}{2}$=12个;
晶胞中最近的R+和Cl-处于体对角线上,距离为体对角线长的$\frac{1}{4}$,晶胞中有4个Cu+,Cl-离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶胞质量为$\frac{4×99.5}{6.02×1{0}^{23}}$g,该晶体密度为1.15 g/cm3,则晶胞体积为$\frac{4×99.5}{6.02×1{0}^{23}}$g÷1.15 g/cm3=$\frac{4×99.5}{1.15×6.02×1{0}^{23}}$cm3,故晶胞棱长为$\root{3}{\frac{4×99.5}{1.15×6.02×1{0}^{23}}}$cm,R+和Cl-距离=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{1.15×6.02×1{0}^{23}}}$cm,
故答案为:Cu;12;$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{1.15×6.02×1{0}^{23}}}$cm.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、杂化方式、化学键、氢键、晶体类型与熔沸点、晶胞计算等,(5)中计算为易错点、难度,需要学生具备一定空间想象与数学计算能力,难度中等.

| A. | 为了防止食品受潮及富脂食品氧化变质,常在包装袋中放入硅胶和硫酸亚铁( ) | |
| B. | 积极推行和使用能被微生物降解的新型聚合物材料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 废旧电池应集中回收,不能填埋处理 |
| A. | 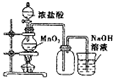 如果MnO2过量,浓盐酸就可全部消耗 | |
| B. | 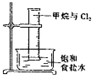 量筒中发生了取代反应 | |
| C. | 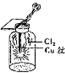 生成蓝色的烟 | |
| D. |  干燥的有色布条褪色,说明氯气有漂白性 |
| A. | 无色溶液中:K+、Na+、Cu2+、SO42- | |
| B. | c(OH-)=10-13 mol•L-1的溶液中:Al3+、NO3-、I-、Cl- | |
| C. | 水电离产生的c(H+)=10-13 mol•L-1的溶液中:Na+、Cl-、NO3-、SO42- | |
| D. | 0.1 mol•L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO- |
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 浓H2SO4不稳定,光照易分解 | |
| D. | CO2、NO2或SO2都会导致酸雨的形成 |
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H═-368.15 kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H═-736.3 kJ•mol-1 | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H═-675.3 kJ•mol-1 | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H═-1 472.6 kJ•mol-1 |
 2,3-二甲基-2-戊烯
2,3-二甲基-2-戊烯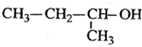 2-丁醇
2-丁醇 二乙酸乙二醇酯
二乙酸乙二醇酯 1,2,4-三甲基苯.
1,2,4-三甲基苯.