题目内容
8.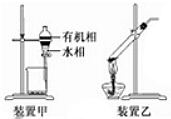 下列实验操作正确的是( )
下列实验操作正确的是( )| A. | 可用磨口玻璃瓶保存NaOH溶液 | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用装置乙加热分解NaHCO3固体 |
分析 A.玻璃中含有二氧化硅,二氧化硅和NaOH溶液反应生成黏性的硅酸钠;
B.立即加入沸石会引起爆沸;
C.分液时,下层液体从下口倒出,上层液体从上口倒出;
D.加热固体药品时,试管口低于试管底.
解答 解:A.玻璃中含有二氧化硅,二氧化硅和NaOH溶液反应生成黏性的硅酸钠,导致瓶塞被黏住而打不开,故A错误;
B.立即加入沸石会引起爆沸,应冷却后再加入,故B正确;
C.分液时,下层液体从下口倒出,上层液体从上口倒出,甲中有机相从上口倒出,否则易引入杂质,故C错误;
D.加热固体药品时,试管口低于试管底,否则水蒸气液化生成的水倒流而炸裂试管,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及实验基本操作、试剂存放等知识点,明确实验原理及实验基本操作方法是解本题关键,易错选项是A.

练习册系列答案
相关题目
18.某同学用下列装置制备并检验Cl2的性质.下列说法正确的是( )
| A. | 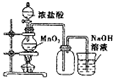 如果MnO2过量,浓盐酸就可全部消耗 | |
| B. | 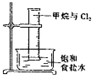 量筒中发生了取代反应 | |
| C. | 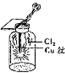 生成蓝色的烟 | |
| D. |  干燥的有色布条褪色,说明氯气有漂白性 |
16. 将洁净的金属片A、B、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表所示:
将洁净的金属片A、B、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表所示:
已知构成原电池两电极的金属活动性相差越大,电压表读数越大.则A、B、C、D四种金属中活泼性最强的是( )
 将洁净的金属片A、B、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表所示:
将洁净的金属片A、B、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表所示:| 金属 | 电子流动方向 | 电压/V |
| A | A→Fe | +0.76 |
| B | Fe→b | -0.18 |
| C | C→Fe | +1.32 |
| D | D→Fe | +0.28 |
| A. | A | B. | B | C. | C | D. | D |
3.用石墨作电极完全电解含1mol溶质X的溶液后,向溶液中加入一定量的物质Y能使电解液恢复到起始状态是( )
| 选项 | X溶液 | 物质Y |
| A | CuCl2 | 1mol Cu(OH)2 |
| B | KOH | 1mol KOH |
| C | Na2SO4 | 1mol H2SO4 |
| D | AgNO3 | 0.5mol Ag2O |
| A. | A | B. | B | C. | C | D. | D |
13.治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是( )


| A. | ab | B. | bc | C. | cd | D. | bd |
17.常温常压时,下列叙述不正确的是( )
| A. | 20mL0.1 mol/L CH3COONa溶液与10mL0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| B. | 含等物质的量的NaHC2O4和Na2C2O4的混合溶液:2 c(Na+)=3[c(HC2O4-)+c(C2O4 2-)+c(H2C2O4)] | |
| C. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH -) | |
| D. | CO2的水溶液:c(H +)>c(HCO3-)=2 c(CO32-) |
18.下列说法正确的是( )
| A. | 0.1mol/L的硫酸溶液中,H+物质的量为0.2mol | |
| B. | 0.1mol-NH2(氨基)中含有的电子数为0.7 mol | |
| C. | 30g SiO2中含有的Si-O键数目为2 mol | |
| D. | 0.1 mol SO2与足量O2反应,转移的电子数为0.2 mol |
 2,3-二甲基-2-戊烯
2,3-二甲基-2-戊烯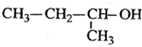 2-丁醇
2-丁醇 二乙酸乙二醇酯
二乙酸乙二醇酯 1,2,4-三甲基苯.
1,2,4-三甲基苯.