题目内容
12.下列叙述正确的是( )| A. | 二氧化硫能使溴水褪色,说明二氧化硫具有漂白性 | |
| B. | 漂白粉和明矾都常用于处理自来水,二者的作用的原理相同 | |
| C. | 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可用酸性高锰酸钾溶液 | |
| D. | 金属单质Na、Al、Fe在一定条件下与水反应都生成氢气和对应的碱 |
分析 A.二氧化硫能够与溴水发生氧化还原反应;
B.漂白粉生成具有强氧化性的次氯酸,明矾水解生成具有吸附性的氢氧化铝;
C.铁离子具有还原性,可与高锰酸钾等氧化剂反应;
D.铁与水蒸气反应生成四氧化三铁.
解答 解:A.二氧化硫能够与溴水发生氧化还原反应使溴水褪色,体现二氧化硫的还原性,故A错误;
B.漂白粉生成具有强氧化性的次氯酸,明矾水解生成具有吸附性的氢氧化铝,二者原理不同,故B错误;
C.亚铁离子具有还原性,可与高锰酸钾等发生氧化还原反应,高锰酸钾溶液褪色,可鉴别,故C正确;
D.铁与水蒸气反应生成四氧化三铁,故D错误;
故选:C.
点评 本题考查了元素化合物知识,明确二氧化硫的还原性、漂白粉的强的氧化性、高锰根离子的氧化性、铁与水蒸气反应的实质是解题关键,题难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.甲醇属于可再生能源,可代替汽油作为汽车的燃料.已知101kPa、常温下16g甲醇完全燃烧放出368.15kJ的热量,下列能正确表示甲醇标准燃烧热的热化学方程式的是( )
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H═-368.15 kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H═-736.3 kJ•mol-1 | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H═-675.3 kJ•mol-1 | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H═-1 472.6 kJ•mol-1 |
3.用石墨作电极完全电解含1mol溶质X的溶液后,向溶液中加入一定量的物质Y能使电解液恢复到起始状态是( )
| 选项 | X溶液 | 物质Y |
| A | CuCl2 | 1mol Cu(OH)2 |
| B | KOH | 1mol KOH |
| C | Na2SO4 | 1mol H2SO4 |
| D | AgNO3 | 0.5mol Ag2O |
| A. | A | B. | B | C. | C | D. | D |
7.下列说法正确的是( )
| A. | ${\;}_{10}^{20}$Ne和${\;}_{10}^{22}$Ne的中子数相同,所以${\;}_{10}^{20}$Ne和${\;}_{10}^{22}$Ne互为同位素 | |
| B. | 1mol CH4与1mol NH${\;}_{4}^{+}$所含质子数相等 | |
| C. | 二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质 | |
| D. | 等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 |
17.常温常压时,下列叙述不正确的是( )
| A. | 20mL0.1 mol/L CH3COONa溶液与10mL0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| B. | 含等物质的量的NaHC2O4和Na2C2O4的混合溶液:2 c(Na+)=3[c(HC2O4-)+c(C2O4 2-)+c(H2C2O4)] | |
| C. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH -) | |
| D. | CO2的水溶液:c(H +)>c(HCO3-)=2 c(CO32-) |
1.下列说法正确的是( )
| A. |  装置可用于实验室制取蒸馏水,从①处通入冷却水 装置可用于实验室制取蒸馏水,从①处通入冷却水 | |
| B. |  萃取操作时,所选萃取剂的密度必须要大于水的密度 萃取操作时,所选萃取剂的密度必须要大于水的密度 | |
| C. |  装置可用于除去固体BaCl2中的MgSO4 装置可用于除去固体BaCl2中的MgSO4 | |
| D. | 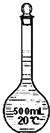 装置在配制一定物质的量浓度的溶液之前无需润洗 装置在配制一定物质的量浓度的溶液之前无需润洗 |
 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: