题目内容
11.有500ml 含Na2CO3与Na2SO4的混合溶液,向其中加入足量的BaCl2溶液,得到66.3g白色沉淀,向所得沉淀中加入足量HCl,最后剩余46.6g沉淀,则溶液中Na+的物质的量浓度为( )| A. | 0.6mol/L | B. | 1mol/L | C. | 1.2mol/L | D. | 0.5mol/L |
分析 6.3g白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水与盐酸,BaCO3溶于盐酸,故白色沉淀中加入过量的稀HCl,充分反应后,剩余沉淀46.6g为BaSO4的质量,可得BaCO3的质量为66.3g-46.6g=19.7g,根据n=$\frac{m}{M}$计算BaCO3和BaSO4的物质的量,Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量,进而可计算原溶液中Na+的物质的量,最后根据c=$\frac{n}{V}$计算出溶液中钠离子浓度.
解答 解:66.3g白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水与盐酸,BaCO3溶于盐酸,故白色沉淀中加入过量的稀HCl,充分反应后,剩余沉淀46.6g为BaSO4的质量,可得BaCO3的质量为66.3g-46.6g=19.7g,BaSO4的物质的量为:$\frac{46.6g}{233g/mol}$=0.2mol,由硫酸根守恒可知n(Na2SO4)=n(BaSO4)=0.2mol,
n(BaCO3)=$\frac{19.7g}{197g/mol}$=0.1mol,由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.1mol,
原溶液中Na+的物质的量为:n(Na+)=2n(Na2CO3)+2n(Na2SO4)=2×0.1mol+2×0.2mol=0.6mol,
溶液中钠离子浓度为:$\frac{0.6mol}{0.5L}$=1.2mol/L,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确发生反应的实质为解答关键,注意熟练掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
2.甲醇属于可再生能源,可代替汽油作为汽车的燃料.已知101kPa、常温下16g甲醇完全燃烧放出368.15kJ的热量,下列能正确表示甲醇标准燃烧热的热化学方程式的是( )
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H═-368.15 kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H═-736.3 kJ•mol-1 | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H═-675.3 kJ•mol-1 | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H═-1 472.6 kJ•mol-1 |
16. 将洁净的金属片A、B、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表所示:
将洁净的金属片A、B、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表所示:
已知构成原电池两电极的金属活动性相差越大,电压表读数越大.则A、B、C、D四种金属中活泼性最强的是( )
 将洁净的金属片A、B、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表所示:
将洁净的金属片A、B、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表所示:| 金属 | 电子流动方向 | 电压/V |
| A | A→Fe | +0.76 |
| B | Fe→b | -0.18 |
| C | C→Fe | +1.32 |
| D | D→Fe | +0.28 |
| A. | A | B. | B | C. | C | D. | D |
3.用石墨作电极完全电解含1mol溶质X的溶液后,向溶液中加入一定量的物质Y能使电解液恢复到起始状态是( )
| 选项 | X溶液 | 物质Y |
| A | CuCl2 | 1mol Cu(OH)2 |
| B | KOH | 1mol KOH |
| C | Na2SO4 | 1mol H2SO4 |
| D | AgNO3 | 0.5mol Ag2O |
| A. | A | B. | B | C. | C | D. | D |
1.下列说法正确的是( )
| A. |  装置可用于实验室制取蒸馏水,从①处通入冷却水 装置可用于实验室制取蒸馏水,从①处通入冷却水 | |
| B. |  萃取操作时,所选萃取剂的密度必须要大于水的密度 萃取操作时,所选萃取剂的密度必须要大于水的密度 | |
| C. |  装置可用于除去固体BaCl2中的MgSO4 装置可用于除去固体BaCl2中的MgSO4 | |
| D. | 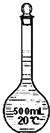 装置在配制一定物质的量浓度的溶液之前无需润洗 装置在配制一定物质的量浓度的溶液之前无需润洗 |
 2,3-二甲基-2-戊烯
2,3-二甲基-2-戊烯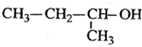 2-丁醇
2-丁醇 二乙酸乙二醇酯
二乙酸乙二醇酯 1,2,4-三甲基苯.
1,2,4-三甲基苯. +CH3CHO$\stackrel{NaOH溶液}{→}$
+CH3CHO$\stackrel{NaOH溶液}{→}$ +H2O
+H2O