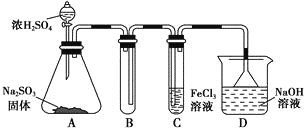
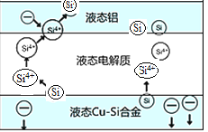
题目内容
【题目】在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是( )
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是( )
A.若降温,该反应的平衡常数增小
B.吸收y mol H2只需1 mol MHx
C.容器内气体密度保持不变时则反应达到了平衡状态
D.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
【答案】C
【解析】
A.反应为放热,反应降低温度,平衡正向移动,则该反应的平衡常数增大,A错误;
B.为可逆反应,1mol MHx(s)与ymol H2(g)不能完全反应,则吸收ymol H2需大于1 mol MHx,B错误;
C.该容器为恒温恒容的密闭容器,容器中只有一种气体—氢气,气体的质量逐渐减小,因此气体密度保持不变,表示达到了平衡状态,C正确;
D.通入少量氢气,平衡正向移动,则v(放氢)<v(吸氢),D错误;
故选C。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
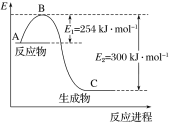
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。