题目内容
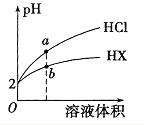
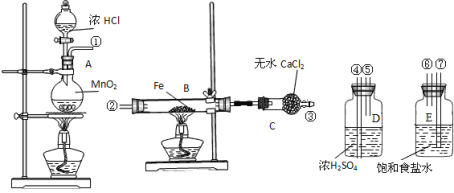
【题目】某温度下,HNO2和CH3COOH的电离常数分別为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中![]() 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
【答案】C
【解析】
电离常数HNO2大于CH3COOH,酸性HNO2大于CH3COOH。
A.由图可知,稀释相同的倍数,Ⅱ的变化大,则Ⅱ的酸性比I的酸性强,Ⅱ代表HNO2,I代表CH3COOH,与题意不符,A错误;
B.酸抑制水电离,b点pH小,酸性强,对水电离抑制程度大,与题意不符,B错误;
C.Ⅱ代表HNO2,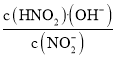 =
=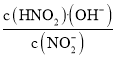 ×
×![]() =
=![]() ,Kw为水的离子积常数,K(HNO2)为HNO2的电离常数,这些常数只与温度有关,温度不变,则K不变,符合题意,C正确;
,Kw为水的离子积常数,K(HNO2)为HNO2的电离常数,这些常数只与温度有关,温度不变,则K不变,符合题意,C正确;
D.体积和pH均相同的HNO2和CH3COOH溶液,c(CH3COOH)>c(HNO2),分别滴加同浓度的NaOH溶液至恰好中和,CH3COOH消耗的氢氧化钠溶液体积多,HNO2消耗的NaOH少,与题意不符,D错误;
答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】空气中的硫酸盐会加剧雾霾的形成,我国科学家用下列实验研究其成因:反应室底部盛有不同吸收液。将SO2和NO2按一定比例混合,以N2或空气为载气通入反应室,相同时间后,检测吸收液中SO42-的含量数据如下表所示,下列说法正确的是
反应室 | 载气 | 吸收液 | SO42-含量 | 数据分析 |
① | N2 | 蒸馏水 | a | b |
② | 3%氨水 | b | ||
③ | 空气 | 蒸馏水 | c | |
④ | 3%氨水 | d |
A.实验表明:酸性环境下,更有利于硫酸盐的形成
B.本研究表明:硫酸盐的形成主要与N2有关
C.反应室①中可能发生反应:SO2+2NO2+2H2O=H2SO4+2HNO2
D.燃煤产生的气体盲目排放会引起酸雨但不会加剧雾霾形成