题目内容
【题目】某溶液中可能含有K+、Ba2+、NH4+、SO42-、CO32-、Cl-中的几种离子:
①取V mL的溶液滴加足量的 BaCl2 溶液,过滤,得到4.30g白色沉淀,往白色沉淀中加入足量的盐酸,沉淀部分溶解,余下2.33g沉淀未溶解;往滤液中滴加足量的AgNO3溶液,生成白色沉淀0.45mol。
②另取原溶液 V mL 与足量的 NaOH固体共热,生成气体 1.12 L(标准状况下)。
根据以上实验,回答下列问题:
(1)溶液中一定存在的阴离子有_____________
(2)溶液中不能确定存在的离子有 _____
(3)实验②发生反应的离子方程式为_____
【答案】SO42-、 CO32-、 Cl- K+ NH4+ +OH-![]() NH3 ↑ + H2O
NH3 ↑ + H2O
【解析】
不溶于盐酸的2.33g沉淀为BaSO4;溶于盐酸的沉淀为BaCO3,质量为4.30g-2.33g=1.97g;因为滴加足量的BaCl2溶液,引入了Cl-,所以加入足量的AgNO3溶液,由生成白色沉淀0.45mol,不能确定溶液中是否含有Cl-;原溶液与足量NaOH固体共热,生成气体为NH3,其体积为1.12 L(标准状况下),由此可确定溶液中含有NH4+;
(1)由上面分析,可确定溶液中一定存在的阴离子有SO42-、CO32-,是否存在Cl-,可利用电荷守恒进行判断;
(2)因为含有SO42-、CO32-,所以溶液中一定不存在Ba2+,再据(1)中分析,确定K+、Cl-是否存在;
(3)实验②发生NH4+与OH-的反应,生成NH3和水。
由上面分析可知,m(BaSO4)= 2.33g,m(BaCO3)= 4.30g-2.33g=1.97g,V(NH3)= 1.12 L。由此可求出n(BaSO4)=![]() =0.01mol,n(BaCO3)=
=0.01mol,n(BaCO3)=![]() =0.01mol,n(NH3)=
=0.01mol,n(NH3)=![]() =0.05mol,从而得出n(SO42-)=0.01mol,n(CO32-)=0.01mol,n(NH4+)=n(NH3)=0.05mol。从离子共存分析,溶液中一定不含有Ba2+;依据电荷守恒,溶液中一定含有Cl-,可能含有K+;
=0.05mol,从而得出n(SO42-)=0.01mol,n(CO32-)=0.01mol,n(NH4+)=n(NH3)=0.05mol。从离子共存分析,溶液中一定不含有Ba2+;依据电荷守恒,溶液中一定含有Cl-,可能含有K+;
(1)由上面分析,可确定溶液中一定存在的阴离子有SO42-、CO32-、Cl-;
答案为:SO42-、 CO32-、Cl-;
(2)溶液中不能确定存在的离子有K+;
答案为:K+;
(3)实验②发生反应的离子方程式为NH4++OH-![]() NH3↑+H2O;
NH3↑+H2O;
答案为:NH4++OH-![]() NH3↑+H2O。
NH3↑+H2O。

【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验仪器,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
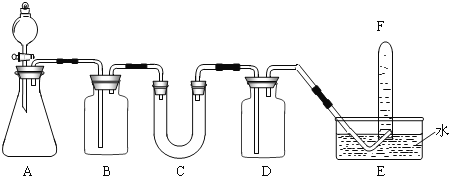
(1)A 是制取 CO2 的装置,可选用的试剂_____(填序号)
①碳酸钙固体与稀硫酸 ②碳酸钠固体与稀盐酸 ③碳酸氢钠固体与氢氧化钠溶液
写出对应的离子方程式_________________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和 NaHCO3 溶液 | ____________ |
C | ____________ | 与 CO2 和水反应产生 O2 |
D | NaOH 溶液 | ____________ |
(3)写出过氧化钠与二氧化碳反应的化学方程式_____。
(4)用_____检验 F 中收集到的气体,现象是_____。