题目内容
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
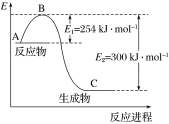
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。
【答案】N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92 kJ·mol-1 390
2NH3(g) ΔH=-92 kJ·mol-1 390 ![]() 2ΔH2-ΔH1
2ΔH2-ΔH1
【解析】
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。

(1)根据图像得出生成1 mol NH3(g)的焓变ΔH =254 kJ·mol-1 - 300 kJ·mol-1 =-46 kJ·mol-1,N2和H2反应的热化学方程式:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92 kJ·mol-1
2NH3(g) ΔH=-92 kJ·mol-1
(2)设N—H键键能为x kJ·mol-1
ΔH = 断键吸收的热量 – 成键放出的热量 = 943 kJ·mol-1 + 435 kJ·mol-1×3 – 6x =
-92 kJ·mol-1
x = 390
故答案为:390;
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
4NH3(g) + 6NO(g) === 5N2(g) +6H2O(g)
要得到目标反应:① - ②×3 即ΔH =(3b-a)kJ·mol-1
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=![]() kJ·mol-1,
kJ·mol-1,
故答案为:![]() ;
;
(4)反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
将第二个反应方程的2倍减去第一个方程得到方程三,ΔH3=2ΔH2-ΔH1,
故答案为:2ΔH2-ΔH1。

 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】空气中的硫酸盐会加剧雾霾的形成,我国科学家用下列实验研究其成因:反应室底部盛有不同吸收液。将SO2和NO2按一定比例混合,以N2或空气为载气通入反应室,相同时间后,检测吸收液中SO42-的含量数据如下表所示,下列说法正确的是
反应室 | 载气 | 吸收液 | SO42-含量 | 数据分析 |
① | N2 | 蒸馏水 | a | b |
② | 3%氨水 | b | ||
③ | 空气 | 蒸馏水 | c | |
④ | 3%氨水 | d |
A.实验表明:酸性环境下,更有利于硫酸盐的形成
B.本研究表明:硫酸盐的形成主要与N2有关
C.反应室①中可能发生反应:SO2+2NO2+2H2O=H2SO4+2HNO2
D.燃煤产生的气体盲目排放会引起酸雨但不会加剧雾霾形成