题目内容
11.E和M均为生活中常见的金属元素.现有如图反应关系: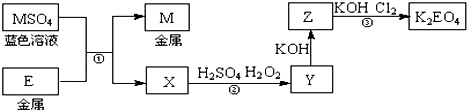
(1)反应①的反应类型是c(填序号).
a.氧化还原反应 b.复分解反应 c.置换反应
(2)Y的溶液可使KSCN溶液显红色.反应②的离子方程式是2Fe 2++H2O2+2H+=2Fe 3++2H2O.
(3)K2EO4为高效绿色净水剂,可通过反应③制得.反应③的化学方程式是2Fe(OH)3+10KOH+3Cl2=2K2FeO4+8H2O+6KCl.
(4)用K2EO4和Zn作原料的电池是一种新型可充电电池,该电池长时间保持稳定的放电电压.其总反应可写成:3Zn+2K2EO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2E(OH)3+4KOH,则充电时的阳极反应是Fe(OH)3-3e-+5OH-=FeO42-+4H2O.放电时消耗32.5g Zn时转移1mol电子.
分析 E利M均为生活中常见的金属元素,MSO4为蓝色溶液,铜盐为蓝色溶液,所以M为Cu,E和硫酸铜发生置换反应生成铜和硫酸盐X,X和稀硫酸、双氧水发生反应生成Y,E能被双氧水氧化,说明E为变价金属,E为生活中常见金属,则E为Fe,X是FeSO4,硫酸亚铁被双氧水氧化生成Fe2(SO4)3,所以Y是Fe2(SO4)3,硫酸铁和氢氧化钾反应生成Fe(OH)3和硫酸钾,Z能被氯气氧化,则Z是Fe(OH)3,结合物质的性质分析解答.
解答 解:E利M均为生活中常见的金属元素,MSO4为蓝色溶液,铜盐为蓝色溶液,所以M为Cu,E和硫酸铜发生置换反应生成铜和硫酸盐X,X和稀硫酸、双氧水发生反应生成Y,E能被双氧水氧化,说明E为变价金属,E为生活中常见金属,则E为Fe,X是FeSO4,硫酸亚铁被双氧水氧化生成Fe2(SO4)3,所以Y是Fe2(SO4)3,硫酸铁和氢氧化钾反应生成Fe(OH)3和硫酸钾,Z能被氯气氧化,则Z是Fe(OH)3,
(1)反应①是一种单质和一种化合物反应生成另外的单质和化合物,属于置换反应,故答案为:c;
(2)Y的溶液可使KSCN溶液显红色,说明Y中含有铁离子,X中含有亚铁离子,亚铁离子和双氧水反应生成铁离子,则亚铁离子作还原剂,双氧水作氧化剂,体现氧化性,离子反应方程式为:2Fe 2++H2O2+2H+=2Fe 3++2H2O,故答案为:2Fe 2++H2O2+2H+=2Fe 3++2H2O;
(3)K2FeO4为高效绿色净水剂,可通过反应③制得,氢氧化铁和氢氧化钾和氯气反应生成高铁酸钾和氯化钾,反应方程式为:2Fe(OH)3+10KOH+3Cl2=2K2FeO4+8H2O+6KCl,
故答案为:2Fe(OH)3+10KOH+3Cl2=2K2FeO4+8H2O+6KCl;
(4)根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钾在正极得到电子,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-则充电池阳极电极方程式为Fe(OH)3-3e-+5OH-=FeO42-+4H2O,
根据电极反应式Zn-2e-+2OH-=Zn(OH)2,每消耗1molZn,转移2mol电子,放电时消耗32.5gZn,即Zn的物质的量=$\frac{32.5g}{65g/mol}$=0.5mol,可知转移电子数为1mol,
故答案为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O;1.
点评 本题铁及其化合物为载体考查了无机物的推断,为高考常见题型,侧重于学生的分析、计算能力的考查,题目以MSO4的颜色为突破口采用正向推导的方法进行推断,结合物质的性质分析解答,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 碳酸钠的水解反应 CO32-+H2O→HCO3-+OH - | |
| B. | 碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-→CaCO3↓+2H2O+CO32- | |
| C. | 苯酚钠溶液与二氧化碳反应 C6H5O-+CO2+H2O→C6H5OH+CO32- | |
| D. | 稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-→3Fe3++2NO↑+4 H2O |
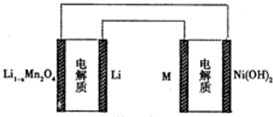 某充电宝锂离子电池的总反应为:xLi+Li1-nMn2O4$?_{充电}^{放电}$LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH$?_{充电}^{放电}$M+Ni(OH)2(M为储氢金属或合金),有关上述 两种电池的说法不正确的是
某充电宝锂离子电池的总反应为:xLi+Li1-nMn2O4$?_{充电}^{放电}$LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH$?_{充电}^{放电}$M+Ni(OH)2(M为储氢金属或合金),有关上述 两种电池的说法不正确的是( )
| A. | 锂离子电池放电时Li+向正极迁移 | |
| B. | 锂离子电池充电时,阴极的电极反应式:LiMn2O4-xe-=Li1-nMn2O4+xLi+ | |
| C. | 如图表示用锂离子电池给镍氢电池充电 | |
| D. | 镍氢电池放电时,正极的电极反应式:NiOOH+H2O+e-=Ni(OH)2+OH- |
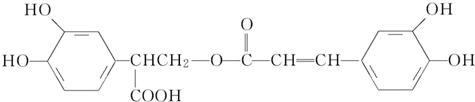 ,
,以邻苯二酚为原料合成迷迭香酸的路线为
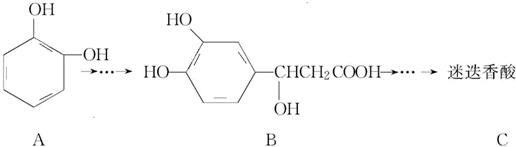
下列说法正确的是( )
| A. | 有机物B可以发生取代、加成、消去、氧化反应 | |
| B. | 有机物A分子中所有原子一定在同一平面上 | |
| C. | 有机物C在浓硫酸催化下水解的一种产物是B | |
| D. | 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH |
| X | Y | |
| Z | W |
| A. | 最高正化合价:Z>X=W>Y | |
| B. | 原子半径:Y>X>W>Z | |
| C. | 最高价氧化物对应水化物的酸性:Z<X<W<Y | |
| D. | 最高价含氧酸的钠盐溶液能与SO2反应的:X、Y、Z、W |
| A. | X2YZ3 | B. | X2YZ4 | C. | X3YZ4 | D. | X4Y2Y7 |
| A. | 最简式为C2H4O的有机物一定可以发生银镜反应 | |
| B. | 不粘锅表面的高分子涂层可以由四氟乙烯通过缩聚反应合成 | |
| C. | 分子结构中含有4个甲基、碳原子数最少的烷烃的系统命名为:2,2-二甲基丙烷 | |
| D. | 甘油和甲苯只有在物质的量之比1:1混合时,充分燃烧后生成的水,才与等质量的甘油充分燃烧后生成的水相同 |
| A. | 0.1 mol•L-1NH4A溶液显中性,说明HA为弱电解质 | |
| B. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| C. | Na、Al、Fe三种单质在一定条件下都能与水反应生成H2和相应的碱 | |
| D. | 水电离出的c(OH-)=1×10-13mol•L-1的溶液中,可能大量存在:Na+、K+、Cl-、HCO3- |