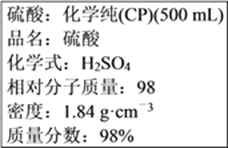
题目内容
【题目】Ⅰ、下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

(1)写出基态时Q元素原子的电子排布式__________,J元素原子的外围电子排布图________________。
(2)下列对比正确的是__________。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(3)关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是______。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
Ⅱ、已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(4)F、G元素对应的最高价含氧酸中酸性较强的化学式为__________。
(5)第一电离能:B__________C,电负性:C__________F。(填“<”、“>”或“=”)
(6)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为____________,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式__________。
(7)写出E与D的最高价氧化物对应的水化物反应的化学方程式______________________ 。
【答案】 1s22s22p63s23p63d104s24p1 3d64s2 cd cd HClO4 > > ![]() Cu+2H+ +H2O2=Cu2+ +2H2O Al(OH)3+NaOH=NaAlO2+2H2O
Cu+2H+ +H2O2=Cu2+ +2H2O Al(OH)3+NaOH=NaAlO2+2H2O
【解析】Ⅰ.(1) Q元素是31号鎵,原子的电子排布式1s22s22p63s23p63d104s24p1,J元素为铁元素,原子的外围电子排布图3d64s2,正确答案:1s22s22p63s23p63d104s24p1;3d64s2。
(2)根据周期表可知:A为碳元素、B为氮元素、C为氧元素、D为氟元素、E为氖元素、 G为铝元素、H 硅元素、Q鎵元素; 原子半径同一周期从左到右减小(稀有气体除外),同一主族从上到下原子半径增大,所以Al>Si, a错误;同一周期从左到右第一电离能增大,氮元素2p能级为半充满状态,第一电离能大于相邻的氧元素,即N>O, B错误;同一周期从左到右电负性增强,同主族从上到下电负性减小,c正确;最高价氧化物的水化物酸性 :HNO3>H2CO3>H2SiO3>Al(OH)3 ,d正确;正确答案:cd。
(3)L为铷元素,位于周期表中第五周期ⅠA族价电子排布为5s1,属于s区元素,a正确;Ⅷ族的元素属于d区,O位于周期表中第七周期Ⅷ族,属于d区元素,b错误;M的外围电子排布式为6s1,属于s区元素,c错误;H所在族位置IVA族,外围电子排布式为ns2np2,属于p区元素,d正确;正确选项ad。
Ⅱ、根据题意分析:A是元素周期表中原子半径最小的元素,A为氢元素;B原子最外电子层的p能级上的电子处于半满状态,B是氮元素;C的最外层电子数是内层电子数的3倍,C是氧元素;C、F属同一主族,F是硫元素;E最外层电子数比最内层多1,E是铝;D3B中阴、阳离子具有相同的电子层结构,D是钠;G原子序数大于硫,G为氯元素;
(4)F是硫元素、G为氯元素;F、G元素对应的最高价含氧酸中H2SO4和HClO4,氯元素的非金属大于硫元素,高氯酸的酸性较强;正确答案:HClO4。
(5)B是氮元素、C是氧元素;由于B原子最外电子层的p能级上的电子处于半满状态,所以第一电离能:B>C;C是氧元素、F是硫元素;电负性:C>F;正确答案:>;>。
6)A为氢元素、C是氧元素;A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X为过氧化氢,电子式为![]() ;Cu、稀硫酸与H2O2反应生成硫酸铜和水,离子方程式为Cu+2H+ + H2O 2=Cu2+ +2 H2O;正确答案:
;Cu、稀硫酸与H2O2反应生成硫酸铜和水,离子方程式为Cu+2H+ + H2O 2=Cu2+ +2 H2O;正确答案:![]() ;Cu+2H+ + H2O 2=Cu2+ +2 H2O。
;Cu+2H+ + H2O 2=Cu2+ +2 H2O。
(7)E是铝、D是钠;D的最高价氧化物对应的水化物为氢氧化钠,E的最高价氧化物对应的水化物为氢氧化铝,氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,化学方程式:Al(OH)3 +NaOH = NaAlO2+2 H2O;正确答案:Al(OH)3 +NaOH = NaAlO2+2 H2O。