题目内容
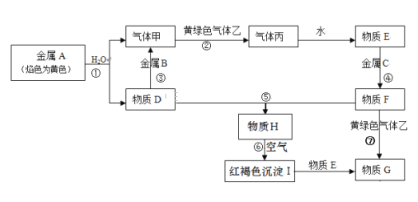
【题目】全钒液流电池装置如图,电解液在电解质储罐和电池间不断循环。下列说法错误的是
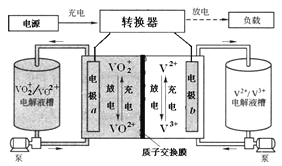
A. 充电时,氢离子通过交换膜移向右侧
B. 充电时,电源负极连接a电极
C. 放电时装置发生的总反应为:VO2++V2++2H+=VO2++V3++H2O
D. 质子交换膜可阻止VO2+与V2+直接发生反应
【答案】B
【解析】分析:本题是一道比较常规的考查电化学知识的试题。解题时应该从图示入手,按照放电的箭头,判断原电池正负极,再按照四个选项的叙述,进行分析。
详解:根据图示的放电箭头,a电极上的反应是VO2+中的+5价V得电子转化为VO2+中的+4价V,所以a为正极,b为负极。
A.充电(电解)时,阳离子应该向阴极(负极)移动,所以氢离子应该通过交换膜移向右侧,选项A正确。
B.电池充电时,正极转化为充电的阳极,负极转化为充电的阴极,所以电源负极应该连接b电极,选项B错误。
C.根据放电的箭头得到,放电时的反应物有:VO2+和V2+,生成物为:VO2+和V3+,所以放电时装置发生的总反应为:VO2++V2++2H+=VO2++V3++H2O(中间是质子交换膜,所以可以在反应物中补充氢离子),选项 C正确。
D.质子交换膜只能允许H+通过,所以可阻止VO2+与V2+直接发生反应,选项D正确。

【题目】部分弱酸的电离平衡常数如表:
(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1
NaHCO3溶液的pH由大到小的关系为_____________________________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度由大到小的顺序为___________________________________。
浓度由大到小的顺序为___________________________________。
(3)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2===2HClO+CO![]() b.2HCOOH+CO
b.2HCOOH+CO![]() ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-===2HCOOH+SO![]() d.Cl2+H2O+2CO
d.Cl2+H2O+2CO![]() ===2HCO
===2HCO![]() +Cl-+ClO-
+Cl-+ClO-
(4)某温度(T ℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示.

① 此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_____。
②在此温度下,0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1 mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显________(填“酸”“碱”或“中”)性.写出按乙方式混合后,反应的离子方程式:__________________________。按甲方式混合后,所得溶液的pH为________。