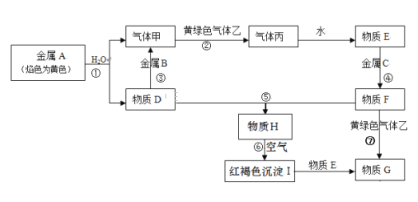
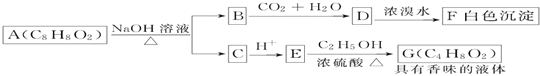
题目内容
【题目】(1)碳酸钠俗称纯碱,可作为碱使用的原因是__________________(用离子方程式表示)。
(2)25℃时,pH均为11的 NaOH 溶液和Na2CO3溶液中,水电离的OH-浓度之比是_____
(3)在0.1 mol·L-1的Na2CO3溶液中,下列粒子浓度关系式正确的是________。
A.[CO32-]+[HCO3-]=0.1 mol·L-1
B.[CO32-]+[HCO3-]+[H2CO3]=0.1 mol·L-1
C.[OH-]=[H+]+[HCO3-]
D.[Na+]+[OH-]=[H+]+[HCO3-]
(4)常温下0.1 mol·L-1的Na2CO3溶液中,离子浓度由大到小的顺序是__________________________________。
(5)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中![]() =__________。(已知Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010,结果保留一位小数)
=__________。(已知Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010,结果保留一位小数)
【答案】 CO![]() +H2O
+H2O ![]() HCO
HCO![]() +OH- 1:108 B [Na+]>[CO32-]>[OH-]>[HCO3-]>[H+] 23.6
+OH- 1:108 B [Na+]>[CO32-]>[OH-]>[HCO3-]>[H+] 23.6
【解析】(1)碳酸钠俗称纯碱,可作为碱使用的原因是碳酸钠水解产生氢氧化钠:CO![]() +H2O
+H2O ![]() HCO
HCO![]() +OH-;(2)25℃时,pH值都等于11的NaOH溶液中,氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,水电离的氢离子为:1×10-11mol/L;pH=11的碳酸钠溶液中,碳酸根离子水解促进了水的电离,溶液中氢氧根离子是水电离的,水电离的氢离子浓度为:
+OH-;(2)25℃时,pH值都等于11的NaOH溶液中,氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,水电离的氢离子为:1×10-11mol/L;pH=11的碳酸钠溶液中,碳酸根离子水解促进了水的电离,溶液中氢氧根离子是水电离的,水电离的氢离子浓度为: ![]() =10-3mol/L,水电离的OH-浓度之比是
=10-3mol/L,水电离的OH-浓度之比是![]() = 1:108;(3)A.碳酸钠溶液中遵循物料守恒,根据物料守恒可知:[CO32-]+[HCO3-]+[H2CO3]= 0.1 mol·L-1,选项A错误;B、碳酸钠溶液中遵循物料守恒,根据物料守恒可知:[CO32-]+[HCO3-]+[H2CO3]= 0.1 mol·L-1,选项B正确;C、碳酸钠溶液中,水电离的氢离子与氢氧根离子一定相等,根据质子守恒可知:[OH-]=[H+]+[HCO3-]+2[H2CO3],选项C错误;D、碳酸钠溶液中,水电离的氢离子与氢氧根离子一定相等,根据质子守恒可知:[OH-]=[H+]+[HCO3-]+2[H2CO3],则[Na+]+[OH-]=[Na+]+[H+]+[HCO3-]+2[H2CO3],选项D错误。答案选B;(4)由于盐类的水解程度很小,故离子浓度大小关系为:[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+];(5)
= 1:108;(3)A.碳酸钠溶液中遵循物料守恒,根据物料守恒可知:[CO32-]+[HCO3-]+[H2CO3]= 0.1 mol·L-1,选项A错误;B、碳酸钠溶液中遵循物料守恒,根据物料守恒可知:[CO32-]+[HCO3-]+[H2CO3]= 0.1 mol·L-1,选项B正确;C、碳酸钠溶液中,水电离的氢离子与氢氧根离子一定相等,根据质子守恒可知:[OH-]=[H+]+[HCO3-]+2[H2CO3],选项C错误;D、碳酸钠溶液中,水电离的氢离子与氢氧根离子一定相等,根据质子守恒可知:[OH-]=[H+]+[HCO3-]+2[H2CO3],则[Na+]+[OH-]=[Na+]+[H+]+[HCO3-]+2[H2CO3],选项D错误。答案选B;(4)由于盐类的水解程度很小,故离子浓度大小关系为:[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+];(5)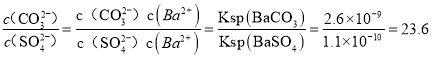 。
。

【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如下图所示(已知A、B、C均为气体)。

(1)该反应的化学方程式为_______。
(2)反应开始至2分钟时,B的平均反应速率为_______。
(3)能说明该反应已达到平衡状态的是_______
A.υ(A)=2υ(B) B.容器内气体密度不变
C.v逆(A)=υ正(C) D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______。
(5)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=_______,V6=_______。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______。
【题目】苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式:
 △H(1)已知:
△H(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ·molˉ1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)一定条件下,在体积不变的密闭容器中,反应过程中各物质浓度随时间变化的关系如下图所示。在t1时刻加入H2,t2时刻再次达到平衡。物质X为__________,判断理由是_______________________。

(3)在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为_________________;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正_______v逆(填“大于”、“小于”或“等于”)。
(4)实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用如图表示。[M=n(H2O)/n(乙苯)]

① 比较图中A、B两点对应的平衡常数大小:KA________KB
② 图中投料比(M1、M2、M3)的大小顺序为________。
【题目】近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。回答下列问题:

(1)汽车发动机工作时会引起反应:N2(g)+O2(g) ![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。一定量NO发生分解的过程中,NO的转化率随时间变化的关系如右图所示。
2NO(g),是导致汽车尾气中含有NO的原因之一。一定量NO发生分解的过程中,NO的转化率随时间变化的关系如右图所示。
①反应2NO(g) ![]() N2(g)+O2(g)为________反应(填“吸热”或“放热”);
N2(g)+O2(g)为________反应(填“吸热”或“放热”);
②一定温度下,能够说明反应2NO(g) ![]() N2(g)+O2(g)已达到平衡的是______(填序号);
N2(g)+O2(g)已达到平衡的是______(填序号);
a.容器内的压强不发生变化 b.混合气体的密度不发生变化
c.NO、N2、O2的浓度保持不变 d.单位时间内分解4 mol NO,同时生成2 mol N2
(2)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)=== 4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mo1-1
写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:______________________;
(3)大气污染物氮氧化物可以用活性炭还原法处理。某研究小组向某0.5L的密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间测得各物质的物质的量如下:
N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间测得各物质的物质的量如下:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.32 | 0.32 |
N2 | 0 | 0.21 | 0.30 | 0.30/span> | 0.34 | 0.34 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.17 | 0.17 |
①0~10min内,NO的平均反应速率v(NO)=________________;T1℃时,该反应的平衡常数K=___________________________;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________(填字母编号)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
f.移出一定量的CO2
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则 H_________0(填“>”或“<”或“=”)。