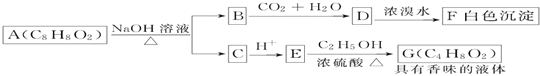
题目内容
【题目】现有含有少量KC1、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如下图所示。
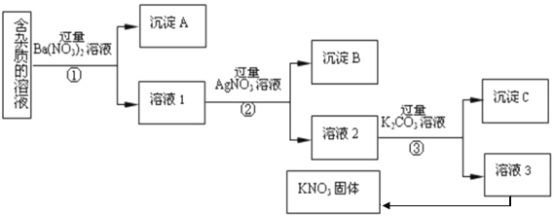
注:KNO3固体容易受热分解
(1)沉淀A的主要成分是___________、___________(填化学式);
(2)为了除去溶液3中的杂质,可以向其中加入适量的___________;除杂后从溶液3获得KNO3晶体的操作是___________、___________、过滤;
(3)步骤③加入过量K2CO3溶液的目的是___________;
(4)实验室用上述实验获得的KNO3体配制450mL0.40 mol/L KNO3溶液,需称取KNO3固体的质量是_____g;
(5)下列操作会导致所配溶液浓度偏大的是(___________)
A.使用了生锈的砝码
B.定容时仰视刻度线
C.容量瓶使用前用蒸馏水洗净但没有干燥
D.固体溶解后未冷却到室温就转移到容量瓶中
【答案】BaSO4 BaCO3 HNO3 蒸发浓缩 冷却结晶 除Ag+ 和 Ba2+ 20.2 AD
【解析】
根据实验流程图,分析各步发生的反应及沉淀的成分和滤液中的溶质,分析实验操作中仪器使用及注意事项。
根据流程图得:①加入过量硝酸钡,生成硫酸钡和碳酸钡沉淀;②加入过量硝酸银,生成氯化银沉淀;③加入过量碳酸钾,生成碳酸银和碳酸钡沉淀,除去过量的硝酸银和过量的硝酸钡;
(1)由上述分析得沉淀A的主要成分是BaSO4、 BaCO3,
故答案为:BaSO4、 BaCO3;
(2)溶液3中的杂质为碳酸钾,可以向其中加入适量的硝酸;从溶液3获得KN03晶体的操作是蒸发浓缩 、冷却结晶、过滤,
故答案为:HNO3、蒸发浓缩、冷却结晶;
(3)根据流程图分析步骤③加入过量K2C03溶液的目的是除Ag+ 和 Ba2+,
故答案为:除Ag+ 和 Ba2+;
(4) 配制450mL溶液选用500mL容量瓶,n(KN03)=cV=0.40 mol/L![]() =0.2mol,m(KN03)=nM=0.2mol×101g/mol=20.2g,
=0.2mol,m(KN03)=nM=0.2mol×101g/mol=20.2g,
故答案为:20.2;
(5)分析溶液中浓度的误差,根据c=![]() 进行分析:
进行分析:
A.使用了生锈的砝码,砝码质量增大,导致称取药品质量偏大,最终浓度偏大,故A正确;
B.定容时仰视刻度线,导致溶液的体积偏大,浓度偏小,故B错误;
C.容量瓶使用前用蒸馏水洗净但没有干燥,并不影响溶液的浓度,故C错误;
D.当溶液冷却时,溶液体积偏小,导致浓度偏大,故D正确;
故选AD。

【题目】苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式:
 △H(1)已知:
△H(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ·molˉ1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)一定条件下,在体积不变的密闭容器中,反应过程中各物质浓度随时间变化的关系如下图所示。在t1时刻加入H2,t2时刻再次达到平衡。物质X为__________,判断理由是_______________________。

(3)在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为_________________;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正_______v逆(填“大于”、“小于”或“等于”)。
(4)实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用如图表示。[M=n(H2O)/n(乙苯)]

① 比较图中A、B两点对应的平衡常数大小:KA________KB
② 图中投料比(M1、M2、M3)的大小顺序为________。
【题目】部分弱酸的电离平衡常数如表:
(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1
NaHCO3溶液的pH由大到小的关系为_____________________________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度由大到小的顺序为___________________________________。
浓度由大到小的顺序为___________________________________。
(3)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2===2HClO+CO![]() b.2HCOOH+CO
b.2HCOOH+CO![]() ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-===2HCOOH+SO![]() d.Cl2+H2O+2CO
d.Cl2+H2O+2CO![]() ===2HCO
===2HCO![]() +Cl-+ClO-
+Cl-+ClO-
(4)某温度(T ℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示.

① 此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_____。
②在此温度下,0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1 mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显________(填“酸”“碱”或“中”)性.写出按乙方式混合后,反应的离子方程式:__________________________。按甲方式混合后,所得溶液的pH为________。