题目内容
【题目】锰及其化合物间的转化如图。
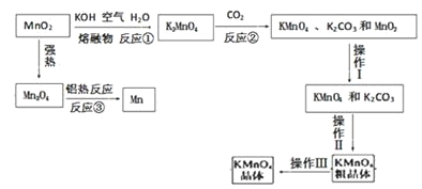
请回答下列问题:
(1)反应①发生的主要化学反应的方程式为:_____。
(2)粗KMnO4晶体中含有少量的K2CO3,为了得到纯的KMnO4晶体,操作Ⅲ的名称为_____。
(3)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀。当____,表明达到滴定终点。
(4)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13。工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=_____。
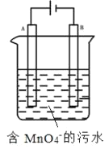
(5)如图,用Fe、C作电极电解含MnO4-的碱性污水,使之转化为Mn(OH)2沉淀除去。A电极是____(填“Fe”或“C”),该电极的产物使碱性污水中MnO4-转化为沉淀除去的离子方程式为____。
【答案】2MnO2+4KOH+O2![]() 2K2MnO4+2H2O 重结晶(或溶解、蒸发浓缩、冷却结晶) 滴入最后一滴硫酸锰溶液,高锰酸钾溶液由紫红色刚好褪色且半分钟不恢复 2.4×10-5mol/L Fe 5Fe2++MnO4-+9OH-+4H2O=5Fe(OH)3↓+Mn(OH)2↓
2K2MnO4+2H2O 重结晶(或溶解、蒸发浓缩、冷却结晶) 滴入最后一滴硫酸锰溶液,高锰酸钾溶液由紫红色刚好褪色且半分钟不恢复 2.4×10-5mol/L Fe 5Fe2++MnO4-+9OH-+4H2O=5Fe(OH)3↓+Mn(OH)2↓
【解析】
将MnO2和KOH粉碎混合,目的是增大反应物的接触面积,加快反应速率,然后将混合物熔融并通入空气,根据流程图知,二者反应生成K2MnO4,根据元素守恒知还生成H2O,K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2,KMnO4、K2CO3易溶于水而MnO2难溶于水,将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,再根据KMnO4、K2CO3溶解度差异采用浓缩结晶、趁热过滤得到KMnO4粗晶体,重结晶得到纯KMnO4晶体。
(1)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水,则反应化学方程式为2MnO2+4KOH+O2![]() 2K2MnO4+2H2O;
2K2MnO4+2H2O;
(2)粗KMnO4晶体中含有少量的K2CO3,为了得到纯的KMnO4晶体,操作Ⅲ是粗晶体提纯,操作的名称为重结晶;
(3)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀,当高锰酸钾溶液由紫红色刚好褪色且半分钟不恢复,表明达到滴定终点;
(4)当pH=10时,c(OH-)=1×10-4 mol/L,根据Ksp[Mn(OH)2]=c(Mn2+)c2(OH-),可知c(Mn2-)=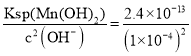 =2.4×10-5mol/L;
=2.4×10-5mol/L;
(5)用Fe、C作电极电解含MnO4-的污水,需要还原剂,电解池中铁做阳极失电子生成亚铁离子,亚铁离子还原高锰酸根离子生成锰离子,在碱溶液中生成氢氧化锰,反应的离子方程式为:5Fe2++MnO4-+9OH-+4H2O=5Fe(OH)3↓+Mn(OH)2↓。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】要准确掌握化学基本概念和研究方法。按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
第二组 | NaOH | HCl | NaCl | Na2O | CO |
第三组 | NaOH | CH3COOH | CaSO4 | H2O2 | SO2 |
每组分类均有错误,其错误的物质分别是________、________、________(填化学式)。
(2)胶体和溶液的本质区别是______________;鉴别胶体和溶液所采用的方法是观察是否能发生______________效应。
(3)下列3个反应,按要求填写相关量。
①2Na2O2+2H2O![]() 4NaOH+O2↑反应中,每生成1分子 O2转移________个电子;
4NaOH+O2↑反应中,每生成1分子 O2转移________个电子;
②2NaHCO3![]() Na2CO3+H2O+CO2↑反应中,每消耗168 gNaHCO3,生成________g CO2;
Na2CO3+H2O+CO2↑反应中,每消耗168 gNaHCO3,生成________g CO2;
③Cl2+H2O![]() HCl+HClO反应中,每消耗10分子 Cl2,转移________个电子。
HCl+HClO反应中,每消耗10分子 Cl2,转移________个电子。