题目内容
4.某化学反应过程中的能量变化关系如图所示,下列结论正确的是( )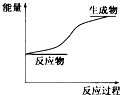
| A. | 生成物的总能量小于反应物的总能量 | |
| B. | 断开化学键所吸收的能量小于形成化学键所放出的能量 | |
| C. | 该反应可能是酸和碱的中和反应 | |
| D. | 该反应中其他形式的能量转化成了化学能 |
分析 A、根据图象判断;
B、根据反应物能量与生成物能量的相对大小判断;
C、酸碱中和反应为放热反应;
D、该反应为能量升高的反应;
解答 解:A、根据图象可知反应物的总能量小于生成物的总能量,故A错误;
B、由图象可知反应物的能量小于生成物的能量,所以该反应属于吸热反应,则断开化学键所吸收的能量大于形成化学键所放出的能量,故B错误;
C、酸碱中和反应为放热反应,而图中的反应为吸热反应,故C错误;
D、该反应为能量升高的反应,即反应中吸收能量,所以该反应中其他形式的能量转化成了化学能,故D正确;
故选D.
点评 本题考查了反应能量变化的分析判断,图象分析是解题关键,反应的能量守恒是判断的依据,题目难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
14.下列反应的离子方程式书写正确的是( )
| A. | 锌粒与稀盐酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 溴化钠溶液与氯气反应:Br-+Cl2=Cl-+Br2 | |
| C. | 氢氧化铜与稀硫酸反应:OH-+H+=H2O | |
| D. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
13.当铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率增大的是( )
| A. | 不用稀硫酸,改用98%的浓硫酸 | B. | 加热 | ||
| C. | 适当增大稀硫酸的浓度 | D. | 不用铁片,改用铁粉 |
14.关于下列变化的比较,正确的是( )
| A. | 氢化物稳定性:HI>HBr>HCl>HF | |
| B. | 酸性强弱:HNO3>H3PO4>H2SO4 | |
| C. | 离子半径由大到小:O2->F->Na+>Mg2+ | |
| D. | 碱性强弱:RbOH<KOH<NaOH<LiOH |
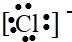 ,C.H2O
,C.H2O ,D.Na2O2
,D.Na2O2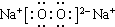 ,
, ;MgCl2
;MgCl2 .
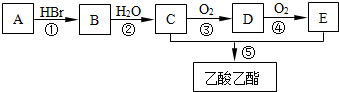
.

 ;B的原子在周期表中的位置是第三周期ⅡA族
;B的原子在周期表中的位置是第三周期ⅡA族