题目内容
13.当铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率增大的是( )| A. | 不用稀硫酸,改用98%的浓硫酸 | B. | 加热 | ||
| C. | 适当增大稀硫酸的浓度 | D. | 不用铁片,改用铁粉 |
分析 增大反应速率的方法有:增大反应物浓度、升高温度、增大压强(仅对有气体参加的反应)、加入催化剂、增大反应物的接触面积等,据此分析解答.
解答 解:A.浓硫酸和铁发生钝化现象,且浓硫酸和铁反应生成二氧化硫而不是氢气,故A选;
B.升高温度,增大活化分子百分数,所以反应速率加快,故B不选;
C.适当增大稀硫酸浓度,增大单位体积内氢离子浓度,反应速率加快,故C不选;
D.不用铁片,改用铁粉,增大反应物接触面积,加快反应速率,故D不选;
故选A.
点评 本题考查化学反应速率影响因素,明确影响化学反应速率的原理是解本题关键,知道各个条件的适用范围,易错选项是A.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.某化学反应过程中的能量变化关系如图所示,下列结论正确的是( )
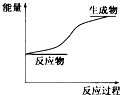

| A. | 生成物的总能量小于反应物的总能量 | |
| B. | 断开化学键所吸收的能量小于形成化学键所放出的能量 | |
| C. | 该反应可能是酸和碱的中和反应 | |
| D. | 该反应中其他形式的能量转化成了化学能 |
8.下列分子中键角最小的是( )
| A. | CH4 | B. | NH3 | C. | H2O | D. | CO2 |
18.在C6H14的各种同分异构体中,所含甲基数目和它的一氯取代物的数目与下列叙述相符的是( )
| A. | 2个-CH3,能生成4种一氯代物 | B. | 3个-CH3,能生成3种一氯代物 | ||
| C. | 3个-CH3,能生成5种一氯代物 | D. | 4个-CH3,能生成4种一氯代物 |
5.如图是实验室常见的气体制取、干燥和收集装置.若用过氧化氢和二氧化锰来制取干燥的氧气,则合理的装置组合为( )


| A. | ①⑤⑥ | B. | ②④⑥ | C. | ②⑤⑦ | D. | ③④⑦ |
2.工业通过氨的催化氧化制取硝酸,其中一个反应3NO2(g)+H2O(l)?2HNO3(aq)+NO(g)△H<0,现欲提高反应物NO2的转化率,增加硝酸的产量,下列采取的措施可行的是( )
| A. | 增加压强 | B. | 加大水量 | C. | 升高温度 | D. | 加入催化剂 |
17.下列事实不能用电化学原理解释的是( )
| A. | 常温条件下,在空气中铝不容易被腐蚀 | |
| B. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| C. | 镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| D. | 远洋海轮的尾部装上一定数量的锌板 |
 ;
; NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.