题目内容
14.关于下列变化的比较,正确的是( )| A. | 氢化物稳定性:HI>HBr>HCl>HF | |
| B. | 酸性强弱:HNO3>H3PO4>H2SO4 | |
| C. | 离子半径由大到小:O2->F->Na+>Mg2+ | |
| D. | 碱性强弱:RbOH<KOH<NaOH<LiOH |
分析 A、元素的非金属性越强,气态氢化物稳定性越强;
B、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
C、电子层越多,半径越大,电子层一样,核电荷数越多,半径越小;
D、元素金属性越强最高价氧化物对应水化物的碱性越强.
解答 解:A、元素的非金属性越强,气态氢化物稳定性越强,元素的非金属性F>Cl>Br>I,气态氢化物稳定性HI<HBr<HCl<HF,故A错误;
B、元素的非金属性:N>S>P,所以酸性HNO3>H2SO4>H3PO4,故B错误;
C、电子层越多,半径越大,电子层一样,核电荷数越多,半径越小,所以离子半径由大到小:O2->F->Na+>Mg2+,故C正确;
D、元素金属性越强最高价氧化物对应水化物的碱性越强,所以碱性强弱:RbOH>KOH>NaOH>LiOH,故D错误;
故选C.
点评 本题考查较为综合,涉及元素非金属性、非金属性,微粒半径大小、氢化物稳定性等知识,侧重于学生的分析能力的考查,注意把握元素周期律的递变规律,难度中等,学习中注意积累.

练习册系列答案
相关题目
4.某化学反应过程中的能量变化关系如图所示,下列结论正确的是( )
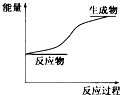

| A. | 生成物的总能量小于反应物的总能量 | |
| B. | 断开化学键所吸收的能量小于形成化学键所放出的能量 | |
| C. | 该反应可能是酸和碱的中和反应 | |
| D. | 该反应中其他形式的能量转化成了化学能 |
5.如图是实验室常见的气体制取、干燥和收集装置.若用过氧化氢和二氧化锰来制取干燥的氧气,则合理的装置组合为( )


| A. | ①⑤⑥ | B. | ②④⑥ | C. | ②⑤⑦ | D. | ③④⑦ |
2.工业通过氨的催化氧化制取硝酸,其中一个反应3NO2(g)+H2O(l)?2HNO3(aq)+NO(g)△H<0,现欲提高反应物NO2的转化率,增加硝酸的产量,下列采取的措施可行的是( )
| A. | 增加压强 | B. | 加大水量 | C. | 升高温度 | D. | 加入催化剂 |
9.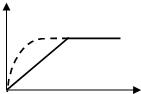 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 加催化剂 | B. | 增大体积 | C. | 升高温度 | D. | 加大X的投入量 |
19.下列说法正确的是( )
| A. | 如图所示 表示乙醇的比例模型 表示乙醇的比例模型 | |
| B. | 蔗糖、纤维素的水解过程都是高分子转化为小分子的过程 | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也不存在同分异构体 | |
| D. | HOCH2COOH既可以发生取代反应又可以发生缩聚反应 |
6.为测定某碳酸氢钠固体的纯度(杂质为氯化钠).称取10.0g此样品至于烧杯中,滴加稀盐酸,测得反应过程中烧杯和药品的总质量随时间的变化数据如下(t0为起始时间):
计算:
(1)反应结束时,收集到CO2的体积(标准状况下);
(2)该样品中NaHCO3的质量分数.
| 反应时间/min | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 烧杯和药品的总质量/g | 210.0 | 206.8 | 205.9 | 205.7 | 205.6 | 205.6 | 205.6 |
(1)反应结束时,收集到CO2的体积(标准状况下);
(2)该样品中NaHCO3的质量分数.
17.下列事实不能用电化学原理解释的是( )
| A. | 常温条件下,在空气中铝不容易被腐蚀 | |
| B. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| C. | 镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| D. | 远洋海轮的尾部装上一定数量的锌板 |
18.下列半径的比较中正确的是( )
| A. | Fe>Fe3+>Fe2+ | B. | Cl>S>P | C. | O2->Na+>Al3+ | D. | Ar>Kr>Xe |