题目内容
2.将1molH2与2mol CO2的混合气体通入容积为2L的密闭容器中,发生如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g)△H=Q kJ•mol-1
测得其化学平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 |
| K | 0.6 | 0.9 | 1.0 |
①上述反应中Q>0 (选填“>”或“<”或“=”).
②在恒温下,能判断该反应已达到化学平衡状态的依据是cd.
a.容器中压强不变
b.该反应的反应热△H不变
c.H2的质量分数不再变化
d.单位时间内生成H2O的物质的量与生成CO2的物质的量相等
(2)850℃时,向2L的密闭容器中通入1mol CO 和 m mol H2O,当反应达到平衡时,平衡混合物中n(H2O)=2n(H2),则m=2.
(3)850℃时,向2L的密闭容器中通入2mol CO 和 4mol H2O,当反应达到平衡时,n (H2)=$\frac{4}{3}$.
(4)850℃时,向2L的密闭容器中通入a mol CO、b mol H2O、c mol CO2和d molH2.
①若要求反应达到平衡时H2的物质的量分数与(3)的相同,则a、b、c、d之间应满足的关系是:(a+c):(b+d)=1:2,且c=d.
②若要求反应向生成H2的方向进行,则a、b、c、d之间应满足的关系是:ab>cd.
分析 (1)①由表中数据可知,随温度升高平衡常数增大,说明升高温度平衡正向移动;
②可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(2)850℃时,向2L的密闭容器中通入1mol CO 和 m mol H2O,当反应达到平衡时,平衡混合物中n(H2O)=2n(H2),则:
CO2(g)+H2(g)?CO(g)+H2O(g)
起始量(mol):0 0 1 m
变化量(mol):x x x x
平衡量(mol):x x 1-x m-x
根据平衡混合物中n(H2O)=2n(H2),确定x、m关系,再结合K=$\frac{c(CO)×c({H}_{2})}{c(C{O}_{2})×c({H}_{2})}$=1计算;
(3)假设平衡时转化的CO为ymol,表示出平衡时各组分物质的量,结合平衡常数K=1列方程计算解答;
(4)①若要求反应达到平衡时H2的物质的量分数与(3)的相同,为等效平衡,反应前后气体体积不变,按化学计量数转化到右边满足n(CO ):n(H2O)=1:2;
②若要求反应向生成H2的方向进行,则浓度商Qc>K=1.
解答 解:(1)①由表中数据可知,随温度升高平衡常数增大,说明升高温度平衡正向移动,正反应为吸热反应,则Q>0,故答案为:>;
②a.反应前后气体体积不变,恒温恒容下,容器中压强始终不变,故a错误;
b.该反应的反应热△H与反应物化学计量数有关,与是否到达平衡无关,故b错误;
c.H2的质量分数不再变化,说明到达平衡,故c正确;
d.单位时间内生成H2O的物质的量与生成CO2的物质的量相等,水的生成与消耗消耗,反应到达平衡,故d正确,
故选:cd;
(2)850℃时,向2L的密闭容器中通入1mol CO 和 m mol H2O,当反应达到平衡时,平衡混合物中n(H2O)=2n(H2),则:
CO2(g)+H2(g)?CO(g)+H2O(g)
起始量(mol):0 0 1 m
变化量(mol):x x x x
平衡量(mol):x x 1-x m-x
平衡混合物中n(H2O)=2n(H2),则m-x=2x,故m=3x,由K=$\frac{c(CO)×c({H}_{2})}{c(C{O}_{2})×c({H}_{2})}$=1可得:$\frac{2x×(1-x)}{x×x}$=1,解得x=$\frac{2}{3}$,故m=2,
故答案为:2;
(3)假设平衡时转化的CO为ymol,表示出平衡时各组分物质的量,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
起始量(mol):0 0 2 4
变化量(mol):y y y y
平衡量(mol):y y 2-y 4-y
则$\frac{(2-y)×(4-y)}{y×y}$=1,解得y=$\frac{4}{3}$,
故答案为:$\frac{4}{3}$;
(4)①若要求反应达到平衡时H2的物质的量分数与(3)的相同,为等效平衡,反应前后气体体积不变,按化学计量数转化到右边满足n(CO ):n(H2O)=1:2,则(a+c):(b+d)=1:2,且c=d,
故答案为:(a+c):(b+d)=1:2,且c=d;
②若要求反应向生成H2的方向进行,则浓度商Qc>K=1,即$\frac{a×b}{c×d}$>1,故ab>cd,
故答案为:ab>cd.
点评 本题考查化学平衡计算、平衡状态判断、平衡常数应用、等效平衡等,难度中等,注意理解掌握平衡常数应用、等效平衡规律.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案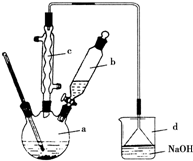 实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:| 苯 | 溴 | 溴苯 | |
| 密度/g.cm3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.写出a中发生反应的化学方程式:2Fe+3Br2═2FeBr3
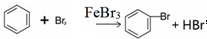 .
.(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入无水氯化钙的目的是干燥.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,需进行的操作方法为蒸馏.
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | -- | 338.0 | 1.84 |
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液.
②按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min.

③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为在一个30mL大试管中注入4mL乙醇,再分别缓缓加入4mL乙酸、1mL浓硫酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀;
写出制取乙酸乙酯的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):BC
A.中和乙酸和乙醇.
B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(3)步骤②中需要小火均匀加热操作,其主要理由是:因为反应物乙醇、乙酸的沸点较低,若用大火加热,反应物大量随产物蒸发而损失原料,温度过高可能发生其它副反应.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,图2装置的主要优点有:(答两点)
①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生
②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量,或增加了冷凝装置,有利于收集产物乙酸乙酯.
| A. | 物质的量就是数量,只是描述对象为微观粒子 | |
| B. | 摩尔质量在数值上等于相对原子(或分子)质量,所以HCl的摩尔质量为36.5 | |
| C. | 阿伏伽德罗常数约为6.02×1023 | |
| D. | 物质的量是一个物理量,它将宏观的质量或体积与微观的粒子数联系起来 |
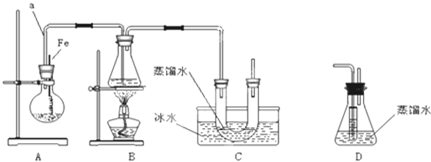
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$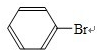 +HBr.
+HBr.